Содержание
Аммиак и его воздействие на организм человека
Аммиак в переводе с греческого (hals ammoniakos) — амонова соль. Аммиак — бесцветный газ с резким запахом, температура плавления — 80° С, температура кипения — 36° С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Чистый аммиак был получен английским химиком и философом Джозефом Пристли в 1774 году. Промышленную технологию получения аммиака разработали и осуществили в 1913 году немецкие химики Фриц. Габер и Карл Бош, получившие за свои исследования Нобелевские премии.
Аммиак — один из самых важных продуктов химической промышленности. Большая часть получаемого в промышленности аммиака идет на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — Nh5Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Аммиак используется для охлаждения каналов энергоснабжения Международной космической станции (МКС), которые обеспечивают МКС электричеством.
На станции есть два независимых аммиачных контура охлаждения, которые отводят тепло от охлаждаемого водой внутреннего оборудования, а также от электрических приборов, установленных на внешней поверхности МКС.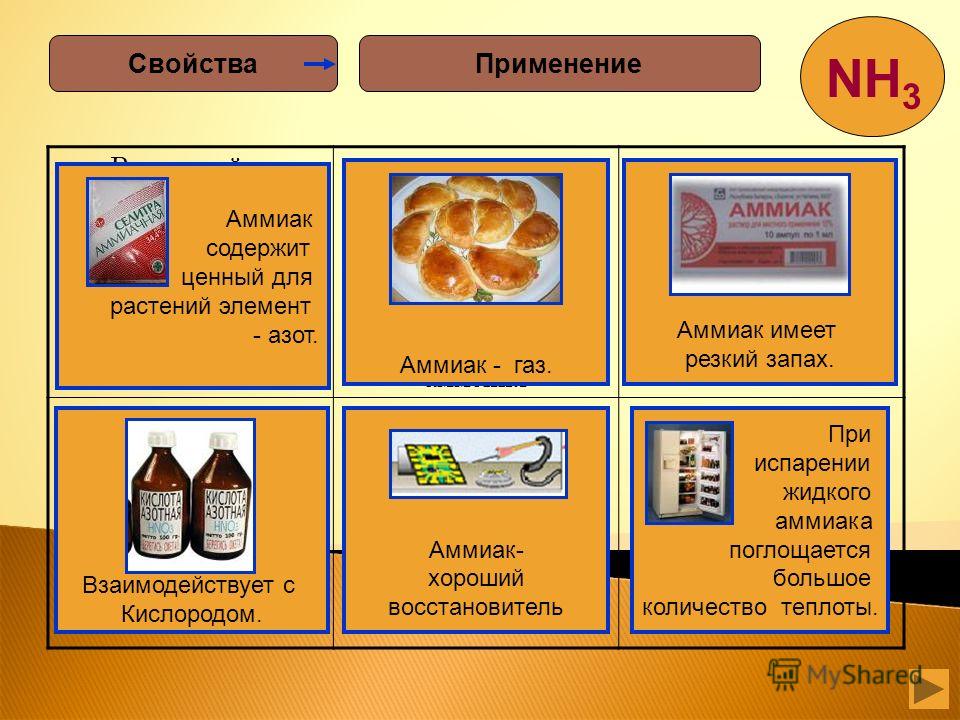
Жидкий аммиак вызывает сильные ожоги кожи, поэтому его обычно перевозят в стальных баллонах (окрашены в желтый цвет, имеют надпись «Аммиак» черного цвета), железнодорожных и автомобильных цистернах, по воде — в специальных танкерах, транспортируют также по трубопроводам.
Смесь аммиака с воздухом взрывоопасна. Аммиак горит при наличии постоянного источника огня. Емкости могут взрываться при нагревании.
Газообразный аммиак является токсичным соединением. При его концентрации в воздухе рабочей зоны около 350 мг/куб. м (миллиграмм на кубический метр) и выше работа должна быть прекращена, а люди выведены за пределы опасной зоны. Предельно допустимая концентрация аммиака в воздухе рабочей зоны равна 20 мг/куб. м.
Аммиак опасен при вдыхании. При остром отравлении аммиаком поражаются глаза и дыхательные пути, при высоких концентрациях возможен смертельный исход. Вызывает сильный кашель, удушье, при высокой концентрации паров — возбуждение, бред. При контакте с кожей — жгучая боль, отек, ожег с пузырями. При хронических отравлениях наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
При хронических отравлениях наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
При попадании аммиака в желудок надо выпить несколько стаканов теплой воды с добавлением одной чайной ложки столового уксуса на стакан воды и вызвать рвоту.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Зону поражения необходимо изолировать. В зону аварии входить только в полной защитной одежде.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду.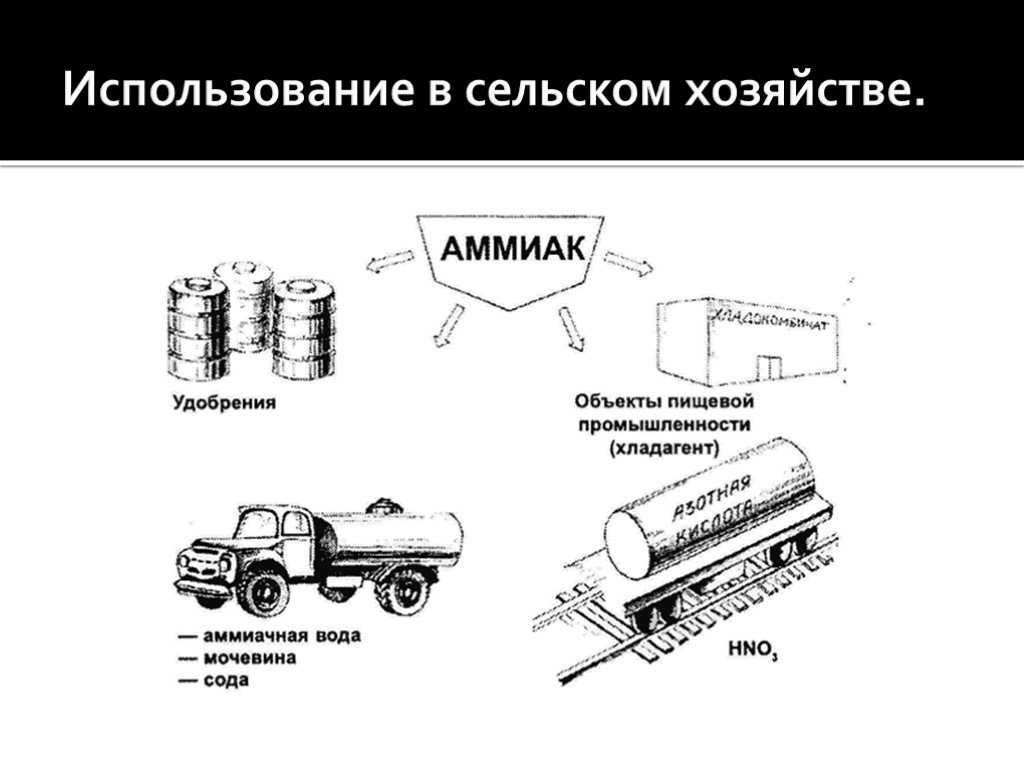
Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Материал подготовлен на основе информации РИА Новости и открытых источников
Получение аммиака в промышленности и в лаборатории из азота
4.2
Средняя оценка: 4.2
Всего получено оценок: 275.
4.2
Средняя оценка: 4.2
Всего получено оценок: 275.
Аммиак (NH3) – соединение азота и водорода. Это лёгкий газ с резким запахом. Получение аммиака в промышленности и лабораториях необходимо для производства удобрений, полимеров, азотной кислоты и других веществ.
В промышленности
Аммиак промышленным путём получают из азота, соединяя его с водородом. Азот берут из воздуха, водород – из воды. Впервые метод разработал немецкий химик Фриц Габер. Промышленный способ получения аммиака стали называть процессом Габера.
Реакция проходит с уменьшением объёма и выделением энергии в виде тепла:
3H2 + N2 → 2NH3 + Q.
Реакция обратима, поэтому необходимо соблюсти несколько условий. При высоком давлении и низких температурах объём полученного аммиака увеличивается. Однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
Опытным путём были найдены необходимые условия для проведения реакции:
- температура – 500°C;
- давление – 350 атм;
- катализатор – оксид железа Fe3O4 (магнетит) с примесями оксидов серебра, калия, кальция и других веществ.

При таких условиях получившийся газ содержит 30 % аммиака. Чтобы избежать обратной реакции, вещество быстро охлаждают. При низких температурах получившийся газ превращается в жидкость. Неизрасходованные газы – азот и водород – возвращаются обратно в колонну для синтеза. Такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.
Рис. 1. Получение аммиака промышленным путём.
Чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
В лаборатории
Для получения аммиака в лаборатории используется реакция щелочей на соли аммония:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
Также аммиак лабораторным путём можно получить из хлорида аммония, нагретого вместе с гашёной известью, или разложением гидроксида аммония:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O;
- NH4OH ↔ NH3↑ + H2O.

Рис. 2. Получение аммиака в лаборатории.
Полностью осушить аммиак можно с помощью смеси извести с едким натрием, через которую пропускают полученный газ. Для этой же цели жидкий аммиак смешивают с металлическим натрием и подвергают дистилляции.
Аммиак легче воздуха, поэтому для его сбора пробирку держат вверх дном.
Применение
Аммиак используется в разных отраслях:
- в сельском хозяйстве – для производства азотсодержащих удобрений;
- в промышленности – для производства полимеров, взрывчатых веществ, искусственного льда;
- в химии – для изготовления азотной кислоты, соды;
- в медицине – в качестве нашатырного спирта.
Рис. 3. Производство удобрений.
Что мы узнали?
Аммиак получают промышленным и лабораторным путём. Для получения в промышленных масштабах используется азот и водород. Смешиваясь под высокой температурой, давлением и под действием катализатора, простые вещества образуют аммиак. Чтобы реакция при высокой температуре не пошла в обратную сторону, газ охлаждают. В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.
В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Максим Гордеев
4/5
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 275.
А какая ваша оценка?
Аммиак — Американское химическое общество
Аммиак — бесцветный ядовитый газ со знакомым ядовитым запахом. Это происходит в природе, в основном в результате анаэробного распада растительного и животного сырья; и он также был обнаружен в космосе. Некоторые растения, в основном бобовые, в сочетании с бактериями-ризобиями «фиксируют» атмосферный азот с образованием аммиака.
Аммиак известен своим запахом с древних времен. Он был выделен в 18 веке известными химиками Джозефом Блэком (Шотландия), Питером Вульфом (Ирландия), Карлом Вильгельмом Шееле (Швеция/Германия) и Джозефом Пристли (Англия). В 1785 году французский химик Клод Луи Бертолле определил его химический состав.
Он был выделен в 18 веке известными химиками Джозефом Блэком (Шотландия), Питером Вульфом (Ирландия), Карлом Вильгельмом Шееле (Швеция/Германия) и Джозефом Пристли (Англия). В 1785 году французский химик Клод Луи Бертолле определил его химический состав.
Аммиак производится в промышленных масштабах посредством каталитической реакции азота и водорода при высокой температуре и давлении. Процесс был разработан в 1909 году немецкими химиками Фрицем Габером и Карлом Бошем. Оба получили Нобелевскую премию по химии за свою работу, но в разные годы: Габер в 1918 году и Бош в 1931 году. Фундаментальный процесс Габера-Боша используется до сих пор.
В 2020 году мировые мощности по производству аммиака составили 224 миллиона тонн (Мт). Фактический объем производства составил 187 млн т. Он занимает девятое место среди химикатов, производимых в мире.
Большая часть производимого аммиака — ≈85% — прямо или косвенно используется в сельском хозяйстве. Химические удобрения, изготовленные из аммиака, включают мочевину, фосфат аммония, нитрат аммония и другие нитраты. Другие важные химические вещества, получаемые из аммиака, включают азотную кислоту, гидразин, цианиды и аминокислоты.
Другие важные химические вещества, получаемые из аммиака, включают азотную кислоту, гидразин, цианиды и аминокислоты.
Аммиак когда-то широко использовался в качестве хладагента. Он был в значительной степени вытеснен хлорфторуглеродами и гидрохлорфторуглеродами, которые также находятся под пристальным вниманием со стороны окружающей среды. Вероятно, самое известное применение аммиака в быту – это средства для мытья стекол.
Аммиак хорошо растворим в воде; его точная растворимость зависит от температуры (см. быстрые факты). Водный аммиак также называют гидроксидом аммония, но эту молекулу нельзя выделить. Когда аммиак используется в качестве лиганда в координационных комплексах, его называют «аммином».
В настоящее время аммиак производится из водорода, полученного из ископаемого топлива, и поэтому не является «зеленым» продуктом, несмотря на его широкое использование в сельском хозяйстве. Но экологически чистый аммиак может появиться на горизонте, если водород будет производиться другими способами, такими как электролиз воды с помощью ветра или солнечной энергии.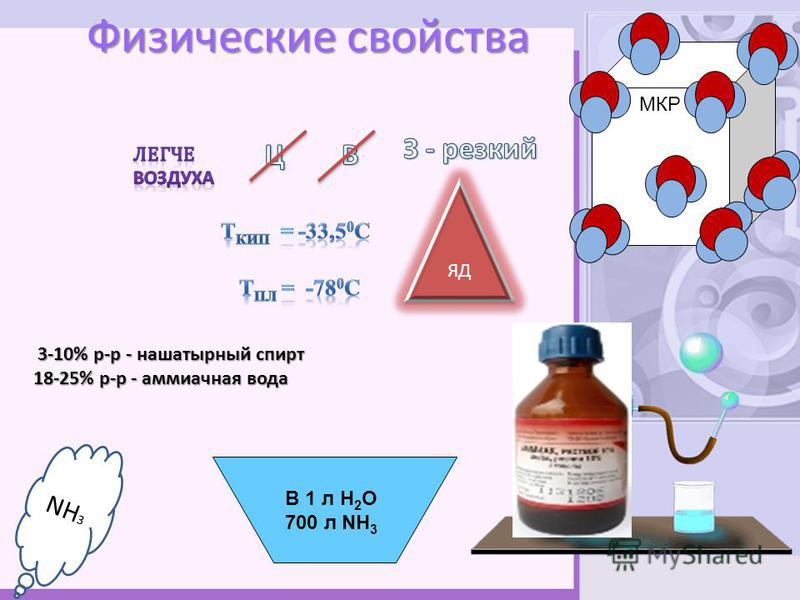
Аммиак можно сжигать в качестве топлива в стандартных двигателях. Исследование, проведенное компанией-производителем катализаторов Haldor Topsoe (Kongens Lyngby, Дания), показало, что замена обычного судового топлива зеленым аммиаком будет рентабельной и устранит значительный источник парниковых газов. Потенциально его также можно использовать в авиационном топливе. В переходный период аммиак можно будет смешивать с обычным топливом.
| Класс опасности* | Краткая характеристика опасности | |
|---|---|---|
| Газы под давлением, сжиженный газ | h380 — содержит газ под давлением; может взорваться при нагревании | |
| Разъедание/раздражение кожи, категория 1B | h414 — вызывает сильные ожоги кожи | |
| Серьезное повреждение/раздражение глаз, категория 1 | h418 — вызывает серьезное повреждение глаз | |
| Острая токсичность при вдыхании, категория 3 | h431 — Токсично при вдыхании | |
| Опасность для водной среды, острая опасность, категория 1 | h500 — очень токсичен для водных организмов | |
| Опасность для водной среды, долговременная опасность, категория 2 | h511 — Токсично для водных организмов с долгосрочными последствиями | |
*Глобально согласованная система классификации и маркировки химических веществ. Пояснения к пиктограммам.
Пояснения к пиктограммам.
Обновление MOTW
L -Триптофан был Молекулой недели 20 ноября 2017 года. Это незаменимая аминокислота, которая должна быть частью рациона человека. Помимо других функций, он позволяет организму синтезировать серотонин и мелатонин. Недавно триптофан появился в двух биохимических исследованиях.
В одном исследовании исследователи из Университета штата Пенсильвания (Университетский парк) и Массачусетского технологического института (Кембридж) обнаружили, что фермент триптофан 2C метилтрансфераза, который катализирует добавление метильной группы к индольному кольцу триптофана в синтезе антибиотика тиострептона , не использует радикальный механизм, как большинство ферментов этого класса. Вместо этого карбоксилатная группа в ферменте действует как общее основание для депротонирования триптофанового субстрата.
Во втором исследовании А. Кит Дункер из Университета Индианы (Блумингтон) и Клара Хлухова из Карлова университета (Прага) вместе пытались выяснить, как зародилась жизнь на Земле. Они предположили, что изначально неупорядоченные белки (IDP), которые не придерживаются определенной конформации, а перемещаются, были вовлечены в этот процесс на ранней стадии. Они считают, что неструктурированные белки, образованные IDP, в конечном итоге были дополнены образующимися позже ароматическими аминокислотами триптофаном и тирозином, которые крупнее и придают белкам большую степень структуры. Они проверили свои идеи, заменив ароматические аминокислоты в ключевом ферменте лейцином; модифицированный, менее структурированный фермент сохранил некоторую активность, но в конечном итоге не работал так же эффективно, как исходный.
Они предположили, что изначально неупорядоченные белки (IDP), которые не придерживаются определенной конформации, а перемещаются, были вовлечены в этот процесс на ранней стадии. Они считают, что неструктурированные белки, образованные IDP, в конечном итоге были дополнены образующимися позже ароматическими аминокислотами триптофаном и тирозином, которые крупнее и придают белкам большую степень структуры. Они проверили свои идеи, заменив ароматические аминокислоты в ключевом ферменте лейцином; модифицированный, менее структурированный фермент сохранил некоторую активность, но в конечном итоге не работал так же эффективно, как исходный.
Факты об аммиаке
| CAS Reg. № | 7664-41-7 |
| SciFinder номенклатура | Аммиак |
| Эмпирическая формула | Н 3 Н |
| Молярная масса | 17,03 г/моль |
| Внешний вид | Бесцветный газ |
| Температура кипения | –33,3 °С |
| Растворимость в воде | ≈530 г/л (20 ºC) ≈320 г/л (25 ºC) |
Обновление MOTW:
15 марта 2021 г.
Аммиак в основном используется в сельском хозяйстве, но теперь он может иметь более «зеленое» применение — в качестве топлива для транспорта. На прошлой неделе статья в Chemical & Engineering News представила промышленное обновление вариантов и препятствий, которые определят , действительно ли аммиак является «топливом будущего».
Аммиак | Определение и использование
аммиак
Посмотреть все СМИ
- Ключевые люди:
- Джозеф Пристли
Фриц Хабер
Герхард Эртль
- Похожие темы:
- Процесс Габера-Боша
нитрат аммония
биогенный газ
гидроксид аммония
безводный аммиак
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
аммиак (NH 3 ) , бесцветный едкий газ, состоящий из азота и водорода. Это простейшее стабильное соединение этих элементов, которое служит исходным материалом для производства многих важных с коммерческой точки зрения соединений азота.
Использование аммиака
В основном аммиак используется в качестве удобрения. В Соединенных Штатах его обычно вносят прямо в почву из резервуаров, содержащих сжиженный газ. Аммиак также может быть в форме солей аммония, таких как нитрат аммония, NH 4 NO 3 , сульфат аммония, (NH 4 ) 2 SO 4 и различные фосфаты аммония. Мочевина, (H 2 N) 2 C=O, является наиболее часто используемым источником азота для удобрений во всем мире. Аммиак также используется в производстве коммерческих взрывчатых веществ (например, тринитротолуола [ТНТ], нитроглицерина и нитроцеллюлозы).
В текстильной промышленности аммиак используется при производстве синтетических волокон, таких как нейлон и вискоза. Кроме того, он используется при окрашивании и чистке хлопка, шерсти и шелка. Аммиак служит катализатором в производстве некоторых синтетических смол. Что еще более важно, он нейтрализует кислые побочные продукты нефтепереработки, а в резиновой промышленности предотвращает коагуляцию латекса-сырца во время транспортировки с плантации на фабрику. Аммиак также находит применение как в аммиачно-содовом процессе (также называемом процессом Сольве), широко используемом методе производства кальцинированной соды, так и в процессе Оствальда, методе преобразования аммиака в азотную кислоту.
Аммиак также находит применение как в аммиачно-содовом процессе (также называемом процессом Сольве), широко используемом методе производства кальцинированной соды, так и в процессе Оствальда, методе преобразования аммиака в азотную кислоту.
Аммиак используется в различных металлургических процессах, включая азотирование листов сплава для упрочнения их поверхности. Поскольку аммиак легко разлагается с образованием водорода, он является удобным портативным источником атомарного водорода для сварки. Кроме того, аммиак может поглощать значительное количество тепла из окружающей среды (например, один грамм аммиака поглощает 327 калорий тепла), что делает его полезным в качестве хладагента в холодильном оборудовании и оборудовании для кондиционирования воздуха. Наконец, среди его второстепенных применений — включение в некоторые бытовые чистящие средства.
Получение аммиака
Чистый аммиак был впервые получен английским ученым-физиком Джозефом Пристли в 1774 году, а его точный состав определил французский химик Клод-Луи Бертолле в 1785 году. Аммиак постоянно входит в пятерку основных химических веществ, производимых в Соединенных Штатах. Основным коммерческим методом производства аммиака является процесс Габера-Боша, который включает прямую реакцию элементарного водорода и элементарного азота.
Аммиак постоянно входит в пятерку основных химических веществ, производимых в Соединенных Штатах. Основным коммерческим методом производства аммиака является процесс Габера-Боша, который включает прямую реакцию элементарного водорода и элементарного азота.
Н 2 + 3Н 2 → 2NH 3
Эта реакция требует использования катализатора, высокого давления (100–1000 атмосфер) и повышенной температуры (400–550 °C [750–1020 °F]). Действительно, равновесие между элементами и аммиаком способствует образованию аммиака при низкой температуре, но для достижения удовлетворительной скорости образования аммиака требуется высокая температура. Можно использовать несколько различных катализаторов. Обычно катализатор представляет собой железо, содержащее оксид железа. Однако в качестве катализаторов использовались как оксид магния на оксиде алюминия, который был активирован оксидами щелочных металлов, так и рутений на угле. В лаборатории аммиак лучше всего синтезировать путем гидролиза нитрида металла.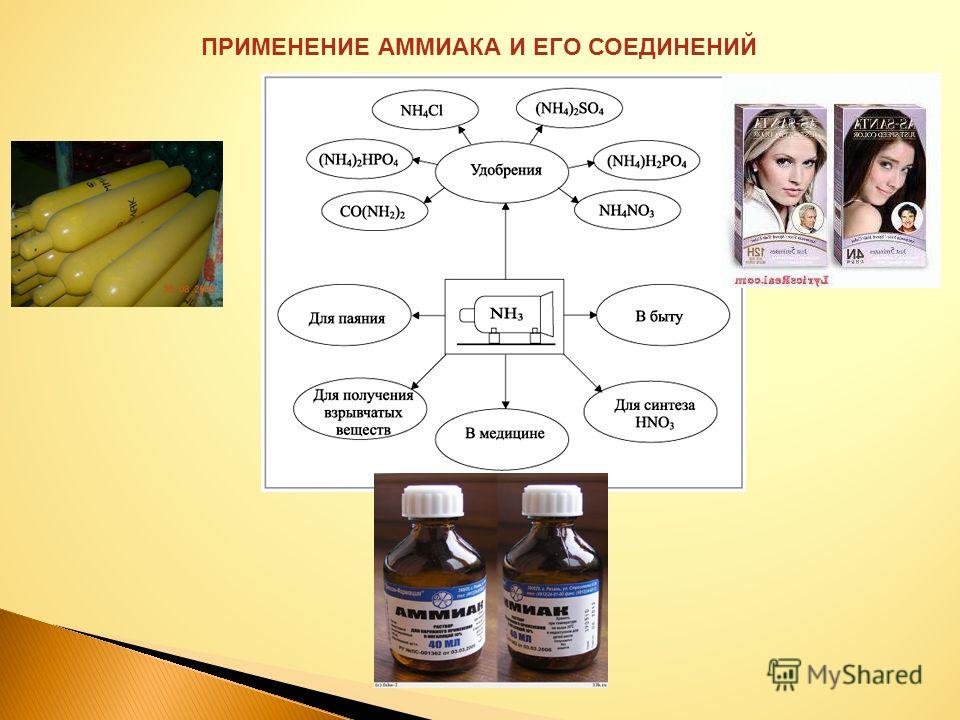
мг 3 N 2 + 6H 2 O → 2NH 3 + 3Mg(OH) 2
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
Физические свойства аммиака
Аммиак — бесцветный газ с резким резким запахом. Его температура кипения составляет -33,35 ° C (-28,03 ° F), а температура замерзания составляет -77,7 ° C (-107,8 ° F). Он имеет высокую теплоту испарения (23,3 кДж на моль при температуре кипения), и с ним можно обращаться как с жидкостью в термоизолированных контейнерах в лаборатории. (Теплота испарения вещества – это количество килоджоулей, необходимое для испарения одного моля вещества без изменения температуры.) Молекула аммиака имеет форму тригональной пирамиды с тремя атомами водорода и неподеленной парой электронов, присоединенной к атом азота. Это полярная молекула, и она сильно ассоциирована из-за сильных межмолекулярных водородных связей. Диэлектрическая проницаемость аммиака (22 при -34 ° C [-29°F]) ниже, чем у воды (81 при 25 °C [77 °F]), поэтому он является лучшим растворителем для органических материалов. Тем не менее, он все еще достаточно высок, чтобы позволить аммиаку действовать как умеренно хороший ионизирующий растворитель. Аммиак также самоионизируется, хотя и в меньшей степени, чем вода.
Тем не менее, он все еще достаточно высок, чтобы позволить аммиаку действовать как умеренно хороший ионизирующий растворитель. Аммиак также самоионизируется, хотя и в меньшей степени, чем вода.
2NH 3 ⇌ NH 4 + + NH 2 −
Химическая активность аммиака
Сгорание аммиака протекает с трудом, но дает газообразный азот и воду.
4НХ 3 + 3O 2 + тепло → 2N 2 + 6H 2 O
Однако при использовании катализатора и при правильных температурных условиях аммиак реагирует с кислородом с образованием оксида азота NO, который окисляется до диоксида азота NO 2 и используется в промышленном синтезе азотной кислоты.
Аммиак легко растворяется в воде с выделением тепла.
NH 3 + H 2 O ⇌ NH 4 + + OH −
Эти водные растворы аммиака являются основными и иногда называются растворами гидроксида аммония (NH 4 OH). Однако равновесие таково, что 1,0-молярный раствор NH 3 дает только 4,2 миллимоля гидроксид-иона. Гидраты NH 3 · H 2 O, 2NH 3 · H 2 O и NH 3 · 2H 2 O существуют и, как было показано, состоят из молекул аммиака и воды, связанных межмолекулярными связями. водородные связи.
Однако равновесие таково, что 1,0-молярный раствор NH 3 дает только 4,2 миллимоля гидроксид-иона. Гидраты NH 3 · H 2 O, 2NH 3 · H 2 O и NH 3 · 2H 2 O существуют и, как было показано, состоят из молекул аммиака и воды, связанных межмолекулярными связями. водородные связи.
Жидкий аммиак широко используется в качестве неводного растворителя. Щелочные металлы, а также более тяжелые щелочноземельные металлы и даже некоторые внутренние переходные металлы растворяются в жидком аммиаке, образуя растворы синего цвета. Физические измерения, в том числе исследования электропроводности, свидетельствуют о том, что этот синий цвет и электрический ток обусловлены сольватированным электроном.
металл (дисперсный) ⇌ металл(NH 3 ) x ⇌ M + (NH 3 ) x + e − (NH 3 ) y
Эти растворы являются отличными источниками электронов для восстановления других химических веществ.

