Содержание
Этилен – из полиэтилена?. Занимательная химия для детей и взрослых
Чтобы продемонстрировать на уроке химии свойства этилена, его надо сначала получить. Обычно его синтезируют действием концентрированной серной кислоты на этиловый спирт. При нагревании смеси в присутствии катализатора (оксида алюминия) происходит дегидратация этанола: СН3–СН2–ОН → СН2=СН2 + Н2О. Иметь дело с концентрированной серной кислотой, да еще горячей, всегда неприятно. Нельзя ли получить этилен как-нибудь еще?
В пособиях по органической химии можно найти способ получения стирола деполимеризацией полистирола при его нагревании. Опыт очень прост: положил в пробирку с газоотводной трубкой кусочки полистирола (от сломанной авторучки, пустой прозрачной баночки из-под таблеток), нагрел – и, пожалуйста, из холодильника уже закапал стирол. А стирол (фенилэтилен С6Н5– СН=СН2), как и другие непредельные соединения-мономеры, обладает высокой реакционной способностью, с ним можно провести самые разнообразные реакции.
Видимо, по аналогии порой пытаются подобным способом – нагреванием (иногда в присутствии серной кислоты) – получить и этилен, используя в качестве сырья старые пакеты, пленки, другие отходы полиэтиленовых изделий. В ходе опыта выделяется газ, который горит, обесцвечивает бромную воду и раствор перманганата калия, т. е. проявляет свойственные этилену реакции. Поэтому считается, что получается именно этилен. Так ли это?
Действительно ли из любого полимера можно, подобрав условия, получить исходный мономер?
На самом деле анализ газа, выделяющегося при нагревании полиэтилена, показывает, что этилена в нем или совсем нет, или очень мало. В чем тут дело? Почему выделяющийся газ «имитирует» этилен, проявляя свойственные ему реакции? Можно ли в принципе получить из полиэтилена этилен?
Реакция радикальной полимеризации (с ее помощью получают полиэтилен, полистирол и многие другие полимеры) обратима, что свойственно многим химическим процессам. Часто при комнатной (или более низкой) температуре она идет слева направо (полимеризация), а при повышенной температуре – справа налево (деполимеризация):
(здесь точка обозначает неспаренный электрон на концевом атоме углерода, Х – заместитель, например С6Н5 в стироле и полистироле, Н – в этилене и полиэтилене, значок ~ указывает на длинную полимерную цепь). В полимерной цепи полиэтилена повторяются звенья –СН2–, а в цепи полистирола – звенья –СН2–СН(С6Н5)–. Равновесие реакции полимеризация – деполимеризация впервые было исследовано в 1945 г. на примере системы стирол – полистирол (реакцию проводили в растворе, где ее легче изучать). Сегодня закономерности подобных процессов изучены достаточно подробно, поскольку они очень важны для практики. И вот что выяснилось. При нагревании многих полимеров в инертной атмосфере (так называемая сухая перегонка) сначала рвется полимерная цепочка. Разрыв связи С–С происходит в самом слабом месте, в частности около разветвления цепи или рядом с заместителем (или случайно присутствующей посторонней группой), например:
В полимерной цепи полиэтилена повторяются звенья –СН2–, а в цепи полистирола – звенья –СН2–СН(С6Н5)–. Равновесие реакции полимеризация – деполимеризация впервые было исследовано в 1945 г. на примере системы стирол – полистирол (реакцию проводили в растворе, где ее легче изучать). Сегодня закономерности подобных процессов изучены достаточно подробно, поскольку они очень важны для практики. И вот что выяснилось. При нагревании многих полимеров в инертной атмосфере (так называемая сухая перегонка) сначала рвется полимерная цепочка. Разрыв связи С–С происходит в самом слабом месте, в частности около разветвления цепи или рядом с заместителем (или случайно присутствующей посторонней группой), например:
~Ch3–CHX–Ch3–ĊHX~ → ~Ch3– ĊHX + ~ Ch3–ĊHX~.
В результате такой реакции образуются два новых свободных радикала. Эта реакция, требующая разрыва прочной углерод-углеродной связи, идет очень медленно при не очень сильном нагревании и поэтому практически не изменяет свойства полимера. Однако образовавшиеся при разрыве цепи свободные радикалы (макрорадикалы), как и низкомолекулярные радикалы, обладают исключительно высокой реакционной способностью; именно быстрые реакции с их участием разрушают полимер. Это происходит не только при нагревании, но и на солнечном свету, при действии кислорода, озона, других активных агентов. Поэтому, например, полиэтиленовая пленка на парнике разрушается намного быстрее, чем полиэтиленовый пакет в темноте. Одно из направлений реакций с участием концевых макрорадикалов мы уже рассматривали – это деполимеризация, когда от конца полимерной цепочки с пулеметной скоростью (а в действительности намного быстрее) «отстреливаются» молекулы мономера, при этом на конце цепи все время сохраняется неспаренный электрон. Бывает и так, что макрорадикал как бы «откусывает» атом водорода от соседней полимерной цепочки (или дальнего конца своей же гибкой цепи):
Однако образовавшиеся при разрыве цепи свободные радикалы (макрорадикалы), как и низкомолекулярные радикалы, обладают исключительно высокой реакционной способностью; именно быстрые реакции с их участием разрушают полимер. Это происходит не только при нагревании, но и на солнечном свету, при действии кислорода, озона, других активных агентов. Поэтому, например, полиэтиленовая пленка на парнике разрушается намного быстрее, чем полиэтиленовый пакет в темноте. Одно из направлений реакций с участием концевых макрорадикалов мы уже рассматривали – это деполимеризация, когда от конца полимерной цепочки с пулеметной скоростью (а в действительности намного быстрее) «отстреливаются» молекулы мономера, при этом на конце цепи все время сохраняется неспаренный электрон. Бывает и так, что макрорадикал как бы «откусывает» атом водорода от соседней полимерной цепочки (или дальнего конца своей же гибкой цепи):
~Ch3– ĊHX + ~Ch3–CHX–Ch3–CHX~ → ~Ch3–Ch3X + ~Ch3–CHX–Ch3– ĊX~.
Образовавшийся макрорадикал весьма неустойчив: неспаренный электрон, очутившийся не на конце, а где-то в середине цепи, немедленно разрезает ее на два куска. Как и при деполимеризации, рвется не соседняя с неспаренным электроном С–С-связь, а следующая (так называемый бета-разрыв):
Как и при деполимеризации, рвется не соседняя с неспаренным электроном С–С-связь, а следующая (так называемый бета-разрыв):
~Ch3–CHX–Ch3– ĊX~ → ~Ch3–CHX + Ch3=CX~.
Новый концевой радикал быстро вступает в дальнейшие реакции. Совокупность этих процессов называется передачей цепи. Место, где отрывается атом водорода и распадается полимерная цепочка, определяется законом случая, поэтому образуются осколки молекул разных размеров. Такие реакции и приводят к разрушению полимера.
Очевидно, что состав продуктов термической деструкции полимера будет зависеть от относительной скорости двух процессов: реакции деполимеризации макрорадикала и реакции передачи цепи. Скорость первого процесса выше у полимеров, содержащих четвертичный атом углерода (он связан только с атомами углерода). Так, при 250 °С скорость деполимеризации полиметилметакрилата (ПММА) примерно в 100 раз выше, чем в случае полиметилакрилата (ПМА). Поэтому неудивительно, что при термической деструкции ПММА выход мономера – метилметакрилата СН2=С(СН3)–СООСН3 достигает 95 %, тогда как из ПМА получается лишь 1 % мономера – метилакрилата (метилового эфира акриловой кислоты, СН2=СН–СООСН3).
Хорошие выходы мономера можно получить также при реакциях деполимеризации поли-α-метилстирола (более 95 % α-метилстирола С6Н5С(СН3)=СН2), полиизобутилена (до 50 % изобутилена СН3–С(СН3)=СН2), полистирола (около 40 % стирола), натурального каучука (из него при этом образуется диеновый мономер с двумя двойными связями – изопрен СН2=С(СН3)–CН=СН3), политетрафторэтилена (тефлона), из которого получается мономер тетрафторэтилен СF2=CF2. В последнем случае передача цепи вообще невозможна из-за очень высокой прочности связи C–F. А вот для полиэтилена преобладает реакция передачи цепи, поэтому среди продуктов его деструкции этилена очень мало.
Для полноты картины следует упомянуть еще один возможный путь деструкции – отщепление от полимера боковых групп. По такому пути при нагревании разлагается поливинилацетат ~СН2–СН(ОСОСН3)~ (от него отщепляется до 95 % уксусной кислоты), поливинилхлорид ~СН2–СНСl~ (отщепляется 95 % HCl), полиакрилонитрил ~СН2–СН(СN)~ (отщепляется HCN, поэтому с этим полимером, как и с тефлоном, опыты проводить не следует из-за ядовитости продуктов).
А что получается при термической деструкции полиэтилена? Почему продукты реакции «маскируются» под этилен? Прежде всего, состав продуктов зависит от условий проведения реакции и типа полиэтилена (разные его марки отличаются плотностью, степенью разветвленности и кристалличности, соотношением молекул разной длины (так называемым молекулярно-массовым распределением), наличием ненасыщенных и других групп, присутствием, иногда до 5 %, винилацетата и других сополимеров). В инертной атмосфере (нагревание в вакууме или в присутствии азота) полиэтилен обычно довольно стоек – примерно до 290 °С, а при более высокой температуре разлагается с образованием смолообразных веществ и газообразных продуктов. Анализ газовой смеси методом масс-спектрометрии позволил обнаружить в ней более 30 (!) соединений, среди которых были алканы, алкены, диены, циклические углеводороды. Вот, например, каков был конкретный состав продуктов, когда разложение проводили при температуре 405 °С: бутенов 25 %, бутана 16,8 %, пропана 15,3 %, этана 14,3 %, пентенов 8,3 %, пентана 6,8 %, этилена 4,8 %, гексенов 3,5 %, гексана и гептана по 1,6 %, СО2 0,3 %. Как видно, этилен – на одном из последних мест.
Как видно, этилен – на одном из последних мест.
Если реакцию проводить на воздухе, то в ней будет участвовать кислород. При этом идут реакции окисления и образуются кислородсодержащие соединения – спирты, альдегиды, кетоны, кислоты, пероксиды. Полиэтилен активно окисляется также под действием азотной и горячей концентрированной серной кислоты, в последнем случае полимер чернеет и обугливается. Химизм этой реакции был изучен в 1983 г. двумя сотрудниками химического факультета Абердинского университета в Шотландии (кстати, это один из старейших университетов в Великобритании – он был основан пять столетий назад). Название статьи, опубликованной в журнале «Деструкция и стабильность полимеров», весьма красноречиво: «Действие концентрированной серной кислоты на полиэтилен и полипропилен. Выделение диоксида серы и диоксида углерода». Авторы поместили полиэтиленовую пленку в литровую колбу, залили ее 98%-ной h3SO4 и нагрели до 100–125 °С, одновременно продувая через колбу инертный газ – сухой гелий и анализируя газообразные продукты реакции с помощью чувствительного метода газожидкостной хроматографии. Прежде всего выяснилось, что процесс идет с автоускорением, т. е. сначала медленно, а затем все быстрее. Предполагается, что сначала полимер реагирует с серной кислотой – сульфируется: ~Ch3–CH~ + HO–SO3H → ~Ch3–CH(SO3H)~ + h3O. Эта реакция особенно легко идет с третичным атомом водорода – у разветвления цепи. Далее сульфогруппы распадаются и одновременно расщепляется полимерная цепь. При этом выделяются SO2, CO2 и пары воды, а в остатке обнаруживаются ненасыщенные соединения – алкены. Таким образом, получить этилен из полиэтилена не удастся. Почему же выделяющиеся при деструкции газы навели некоторых химиков на мысль о том, что это этилен? Дело в том, что и алкены, и сернистый газ (он образуется в случае реакции с серной кислотой) могут обесцвечивать и бромную воду, и раствор перманганата, а присутствующие в газовой смеси в большом количестве углеводороды легко загораются. Поэтому, не имея возможности проанализировать состав продуктов, можно легко принять их свойства за признак образования этилена.
Прежде всего выяснилось, что процесс идет с автоускорением, т. е. сначала медленно, а затем все быстрее. Предполагается, что сначала полимер реагирует с серной кислотой – сульфируется: ~Ch3–CH~ + HO–SO3H → ~Ch3–CH(SO3H)~ + h3O. Эта реакция особенно легко идет с третичным атомом водорода – у разветвления цепи. Далее сульфогруппы распадаются и одновременно расщепляется полимерная цепь. При этом выделяются SO2, CO2 и пары воды, а в остатке обнаруживаются ненасыщенные соединения – алкены. Таким образом, получить этилен из полиэтилена не удастся. Почему же выделяющиеся при деструкции газы навели некоторых химиков на мысль о том, что это этилен? Дело в том, что и алкены, и сернистый газ (он образуется в случае реакции с серной кислотой) могут обесцвечивать и бромную воду, и раствор перманганата, а присутствующие в газовой смеси в большом количестве углеводороды легко загораются. Поэтому, не имея возможности проанализировать состав продуктов, можно легко принять их свойства за признак образования этилена.
это, виды, свойства, технология получения
Сокращения: ПЭ, PE
Тип полимера: Полиолефины
Полиэтилен — это карбоцепной полимер алифатического непредельного углеводорода олефинового ряда – этилена. Макромолекулы полиэтилена имеют линейное строение с небольшим числом боковых ответвлений. Его структурная формула выглядит следующим образом:
Различают 3 вида полиэтилена: ПВД (полиэтилен высокого давления, ПЭНП), ПСД (полиэтилен среднего давления) и ПНД (полиэтилен низкого давления, ПЭВП).
Знаки вторичной переработки для полиэтилена высокой и низкой плотности:
Что касается свойств полиэтилена, отмечаются присущие ему хорошие электроизоляционные свойства, сохраняющиеся в широком интервале частот, влагостойкость, инертность по отношению к агрессивным химическим средам, хорошие механические показатели (значительная разрывная прочность и высокая эластичность, сохраняющаяся при низких температурах) и прекрасные технологические данные. Естественно, что те или иные показатели зависят от способа получения полиэтилена и могут варьироваться в ту или иную сторону в зависимости от молекулярной массы.
Естественно, что те или иные показатели зависят от способа получения полиэтилена и могут варьироваться в ту или иную сторону в зависимости от молекулярной массы.
Эти и другие показатели полиэтилена значительно меняются от способа полимеризации. Например, полиэтилен, получаемый при высоком давлении (радикальная полимеризация), характеризуется более низкой температурой плавления и плотностью, чем полиэтилен, получаемый ионной полимеризацией (при получении полиэтилена при низком или среднем давлении). Получаемые полимеры несколько различаются и по свойствам, и, как следствие, по режимам переработки в изделия и их качеству. Ниже в таблице приведены основные физико-механические свойства ПЭВП и ПЭНП и химический состав:
Также полиэтилен обладает достаточной стойкостью к кислотам, щелочам и действию воды. При комнатной температуре на него не действуют кислоты, кроме 50%-ой азотной кислоты, жидкого и газообразного фтора и хлора. Взаимодействие полиэтилена с галогенами применяется для переработки отходов полиэтилена. Также полиэтилен растворим в циклогексане и четыреххлористом углероде при 80 °C. Со временем подвергается деструкции с образованием поперечных межцепных связей, что приводит к повышению хрупкости на фоне небольшого увеличения прочности. Нестабилизированный полиэтилен на воздухе подвергается термоокислительной деструкции (термостарению).
Также полиэтилен растворим в циклогексане и четыреххлористом углероде при 80 °C. Со временем подвергается деструкции с образованием поперечных межцепных связей, что приводит к повышению хрупкости на фоне небольшого увеличения прочности. Нестабилизированный полиэтилен на воздухе подвергается термоокислительной деструкции (термостарению).
В промышленности для производства полиэтилена ВД применяют обычно два типа установок, отличающиеся конструкцией реактора. Реакторы представляют собой либо трубчатые аппараты, работающие по принципу ИВ (идеального вытеснения), либо вертикальные цилиндрические аппараты с перемешивающим устройством – автоклавы с мешалкой, работающие по принципу ИС (идеального смешения).
Для получения полиэтилена с высокой молекулярной массой и плотностью полимеризацию проводят при высоких давлениях. Это обуславливает применение толстостенных металлических труб и аппаратов с ограниченной поверхностью теплообмена. Для обеспечения высоких скоростей процесса, его проводят при температуре около 200 — 300°C.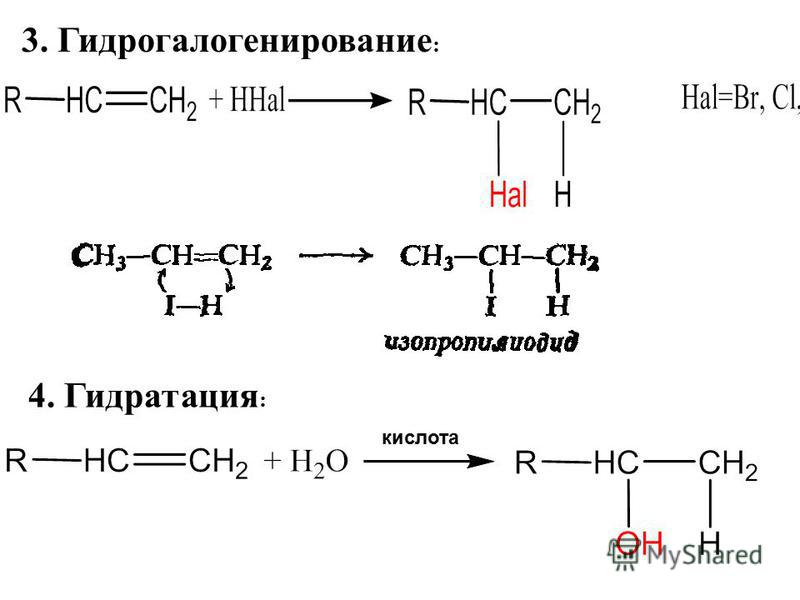 Верхний предел ограничивается условиями взрывобезопасности, а также зависит от рабочего давления в реакторе.
Верхний предел ограничивается условиями взрывобезопасности, а также зависит от рабочего давления в реакторе.
Следует отметить, что процессы полимеризации в трубчатом реакторе и автоклаве различаются температурным режимом и временем пребывания реакционной массы в аппарате.
Рассматривая процесс получения ПВД в трубчатом реакторе, можно выделить несколько стадий: смешение свежего этилена с возвратным газом и кислородом, двухкаскадное сжатие газа, полимеризация этилена в конденсированной фазе, разделение ПВД и непрореагировавшего этилена, поступающего в рецикл, грануляция продукта.
На рисунке приведена схема процесса производства полиэтилена высокого давления в газовой фазе, где:
- 1 – коллектор
- 2 – смеситель этилена НД
- 3 – компрессор первого каскада
- 4 – смеситель этилена ВД
- 5 – компрессор второго каскада
- 6 – трубчатый реактор
- 7 – отделитель этилена ВД
- 8 – отделитель НД
- 9 – гранулирующий агрегат
- 10 – вибросито
- 11, 14 – циклонные сепараторы
- 12, 15 – холодильники
- 13, 16 – фильтры
- 17 – компрессор предварительного сжатия
Из цеха газоразделения свежий этилен под давлением 0,8 – 1,1 Мпа поступает в коллектор 1 и затем в смеситель 2, в котором смешивается с возвратным этиленом низкого давления. Далее в поток вводят кислород и смесь поступает в трехступенчатый компрессор первого каскада 3, где сжимается до 25 Мпа. После каждой ступени сжатия этилен охлаждается в холодильниках, отделяется от смазки в сепараторах, а затем поступает в смеситель 4, в котором смешивается с возвратным этиленом ВД из отделения 7. Затем смесь направляется в двухступенчатый компрессор 5 второго каскада, где сжимается до 245 Мпа. После первой ступени сжатия этилен охлаждается в холодильнике, очищается от смазки в сепараторах, а после второй ступени при температуре 70°C поступает в трубчатый реактор 6 на полимеризацию.
Далее в поток вводят кислород и смесь поступает в трехступенчатый компрессор первого каскада 3, где сжимается до 25 Мпа. После каждой ступени сжатия этилен охлаждается в холодильниках, отделяется от смазки в сепараторах, а затем поступает в смеситель 4, в котором смешивается с возвратным этиленом ВД из отделения 7. Затем смесь направляется в двухступенчатый компрессор 5 второго каскада, где сжимается до 245 Мпа. После первой ступени сжатия этилен охлаждается в холодильнике, очищается от смазки в сепараторах, а после второй ступени при температуре 70°C поступает в трубчатый реактор 6 на полимеризацию.
Реактор – полимеризатор состоит из трех зон, перед каждой зоной имеется теплообменник для подогрева газа или реакционной смеси в зависимости от применяемого инициатора до 120-190°C. В конце третьей зоны имеется холодильник, в котором реакционная масса охлаждается до 200-250°C (теплообменники и холодильник на схеме не показаны).
Из трубчатого реактора 6 смесь непрореагировавшего мономера с полимером через редукционный вентиль под давлением 24,5 – 26,3 Мпа поступает в отделитель высокого давления, в котором за счет разности плотностей этилена и полиэтилена происходит их разделение. Непрореагировавший этилен из верхней части отделителя высокого давления 7 направляется в циклонные сепараторы 11 и холодильники 12, где от этилена отделяются унесенные частицы полиэтилена. Затем этилен охлаждается, поступает на смешение со свежим газом в смеситель 4 и возвращается в цикл.
Непрореагировавший этилен из верхней части отделителя высокого давления 7 направляется в циклонные сепараторы 11 и холодильники 12, где от этилена отделяются унесенные частицы полиэтилена. Затем этилен охлаждается, поступает на смешение со свежим газом в смеситель 4 и возвращается в цикл.
Из нижней части отделения ВД 7 расплавленный полиэтилен направляется в отделитель низкого давления 8, в котором поддерживается давление 0,15-0,59 Мпа. Расплав полиэтилена, освобожденный от остатков растворенного этилена при 180-190°C, направляется в гранулирующие агрегаты 9.
Этилен из отделителей низкого давления 8 и после очистки и охлаждения в циклонном сепараторе 14, холодильнике 15 и фильтре 16 поступает в компрессор предварительного сжатия (0,9 – 1,7 Мпа) 17, затем в коллектор 1 свежего этилена и возвращается в цикл.
В грануляторы 9 непрерывно подается стабилизирующая смесь и другие добавки. Полиэтилен, смешанный со стабилизатором, направляется на грануляцию. Для быстрого охлаждения гранул в гранулирующую головку подается обессоленная вода.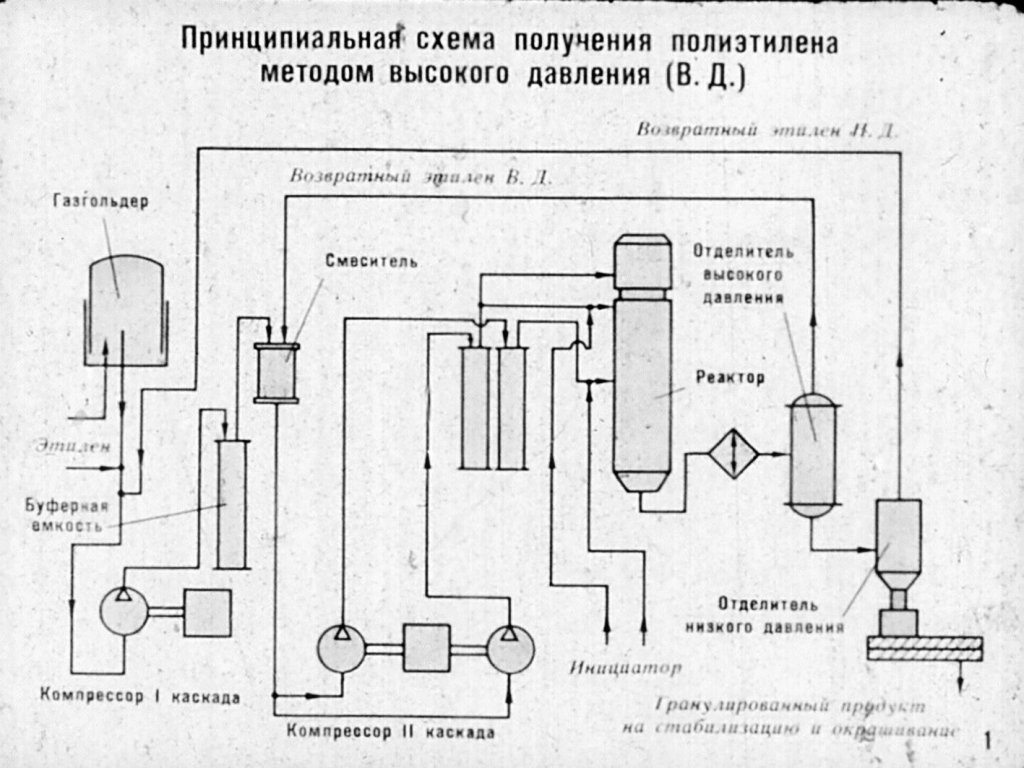 Охлажденные до 60-70°C гранулы полиэтилена выносятся водой на вибросито 10, на которое потом подается теплый воздух для окончательной сушки. Готовый полиэтилен упаковывают в мешки или направляют на конфекционирование.
Охлажденные до 60-70°C гранулы полиэтилена выносятся водой на вибросито 10, на которое потом подается теплый воздух для окончательной сушки. Готовый полиэтилен упаковывают в мешки или направляют на конфекционирование.
Что касается ПНД, то его получают ионной или ионно-координационной полимеризацией в газовой и жидкой фазе. Процесс проводят под давлением 0,3 – 2,5 Мпа, при температуре 70-105°C в присутствии катализаторов Циглера – Натта, высокоактивных хроморганических катализаторов и оксидов хрома.
Рассмотрим схему процесса производства полиэтилена низкого давления в газовой фазе:
1 – реактор-полимеризатор
2 – отделитель
3 – емкость для продувки
4 – емкость для катализатора
5 – воздушный холодильник
6 – циркуляционный компрессор
Полимеризацию проводят в реакторе-полимеризаторе 1. Единичная мощность реактора 70 тыс. т полиэтилена в год. В реактор полимеризации из емкости 4 пневмотранспортом с помощью очищенного азота высокого давления подается порошкообразный катализатор.
Количество подаваемого катализатора регулируется роторным дозатором. Для получения полимера заданной молекулярной массы в реактор вводят водород, а для изменения плотности – сомономеры – бутилен, пропилен.
Полимеризация проводится в псевдоожиженном слое. В нижней части реактора имеется перфорированная решетка для равномерного распределения подаваемого этилена и создания кипящего слоя, а в верхней части – расширенная зона, предназначенная для снижения скорости газа и улавливания основной массы частиц полимера. Теплота реакции отводится за счет циркуляции газа, охлаждаемого в воздушном холодильнике 5 циркуляционного контура. Циркуляция газа осуществляется с помощью одноступенчатого центробежного компрессора 6. Образующийся полиэтилен накапливается в нижней части реактора. Степень конверсии этилена составляет 97%. Выгрузка полиэтилена из реактора циклическая – время цикла 6 минут.
Полимер после выгрузки из реактора поступает в отделитель 2, в котором полиэтилен отделяется от непрореагировавшего этилена. Этилен направляется на очистку и возвращается в цикл, а полиэтилен поступает в емкость 3 для продувки инертным газом (азотом), продувной газ выходит через фильтр для улавливания мелких частичек ПЭ.
Этилен направляется на очистку и возвращается в цикл, а полиэтилен поступает в емкость 3 для продувки инертным газом (азотом), продувной газ выходит через фильтр для улавливания мелких частичек ПЭ.
Далее полиэтилен поступает на компаундирование (стабилизацию и грануляцию), а затем на расфасовку и упаковку готового продукта.
Естественно, что от вариаций производства полиэтилена меняются не только его свойства, но и обозначения – маркировки.
В данной таблице последние две цифры указывают на тип добавки и свойства композиции. Например, 01 для суспензионного полиэтилена любой марки – антикоррозионная добавка; нестабилизированная, неокрашенная.
Область применения полиэтилена довольно широка. Так, этот полимер можно встретить в виде пленки (пузырчатая упаковка), тары (бутылки, ящики, канистры, садовые лейки, даже горшки для рассады), труб для канализации, электроизоляционного материала, брони в бронежилетах, корпусов для лодок. Вдобавок ко всему, вспененный полиэтилен (пенополиэтилен) используется как теплоизолятор, а ПНД применяется при строительстве полигонов переработки отходов, накоплений различных веществ. Также полиэтилен используется для радиационной защиты от нейтронного излучения, а с добавлением бора его эффективность значительно усиливается.
Также полиэтилен используется для радиационной защиты от нейтронного излучения, а с добавлением бора его эффективность значительно усиливается.
Малотоннажная марка полиэтилена, отличающаяся отсутствием низкомолекулярных добавок, высокой линейностью и молекулярной массой, применяется в медицине как замена хрящевых суставов, но, к сожалению, встречается довольно редко из-за трудностей переработки, обусловленной низким ПТР.
Известно, что, для борьбы с загрязнением окружающей среды полиэтиленовыми пакетами (которые часто путают с целлофановыми), около 40 стран мира ввели запрет или ограничение на продажу и производство пластиковых пакетов.
Как сделать полиэтилен | Наука
••• Крис Клинтон/Lifesize/Getty Images
Обновлено 25 апреля 2017 г.
Автор Robert Paxton
Полиэтилен является наиболее часто используемой формой пластика. Из него делают пластиковые пакеты, бутылки и детские игрушки. Как и другие пластмассы, он состоит из полимеров или длинных цепочек молекул. В этом случае молекулы полностью состоят из атомов углерода и водорода. Вы можете производить полиэтилен, очищая некоторое количество этилена, известного как исходное сырье, перед добавлением катализатора. При этом начнется реакция, в результате которой молекулы этилена образуют полимерный полиэтилен.
В этом случае молекулы полностью состоят из атомов углерода и водорода. Вы можете производить полиэтилен, очищая некоторое количество этилена, известного как исходное сырье, перед добавлением катализатора. При этом начнется реакция, в результате которой молекулы этилена образуют полимерный полиэтилен.
- Этилен Фейсток
- Регулятор чистоты
- Реакционный резервуар
- Бензил -перекись
- Pelletizer
Очистка этиленового сырья. При производстве этилена этот мономер может поглощать многие примеси, такие как влага, сера и аммиак. При хранении и транспортировке могут появиться дополнительные примеси. Пропустите этилен через регулятор чистоты. Это устройство смешивает несколько газов с исходным этиленом под высоким давлением и удаляет примеси и посторонние вещества. В конце процесса очистки этилен пропускают в реакционный резервуар.
Добавить катализатор в очищенный этилен. Типичным катализатором, используемым в этом процессе, является перекись бензила. Молекулы бензилпероксида способны распадаться. Молекула бензилпероксида распадается на две части, каждая из которых имеет неспаренный электрон. Этот тип фрагмента молекулы называется свободным радикалом. Неспаренный электрон в свободном радикале теперь будет искать электроны для соединения с этиленовым сырьем.
Этот тип фрагмента молекулы называется свободным радикалом. Неспаренный электрон в свободном радикале теперь будет искать электроны для соединения с этиленовым сырьем.
Дайте перекиси бензила прореагировать с этиленом. Поскольку фрагменты молекул катализатора отбирают электроны у ранее стабильных молекул этилена, последние теперь пытаются восполнить недостающие электроны, отбирая электроны у других молекул этилена и образуя с ними связь. Каждый раз, когда это происходит, возникает электронная щель, которая должна быть заполнена за счет связывания с еще одной молекулой этилена. При малом количестве примесей в сырье этот процесс может продолжаться длительное время.
Добавляйте больше катализатора всякий раз, когда реакция начинает замедляться. Это будет происходить по мере того, как растущие цепочки молекул находят друг друга и соединяются, заканчивая поиск электронов для заполнения пробелов, созданных начальной реакцией. Больше катализатора перезапустит реакцию.
Засыпать полиэтилен в гранулятор. Эта машина формирует небольшое количество полиэтилена в гранулы для хранения и транспортировки. Затем эти крошечные гранулы можно повторно нагреть и придать им любую форму.
Эта машина формирует небольшое количество полиэтилена в гранулы для хранения и транспортировки. Затем эти крошечные гранулы можно повторно нагреть и придать им любую форму.
Вещи, которые вам понадобятся
Связанный арт. В центре: Свободно-радикальная полимеризация винила
Об авторе
Роберт Пакстон профессионально пишет с 2002 года, когда он опубликовал свой первый роман. Он также публиковал рассказы и стихи и писал рекламные тексты для различных веб-сайтов. Окончил Аризонский университет в 1995 со степенью бакалавра писательского мастерства. Пакстон — обученный Монтессори-инструктор, который преподавал как на начальном, так и на среднем уровне.
Авторы фотографий
Крис Клинтон/Lifesize/Getty Images
Полимеризация этилена – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25766
Этот модуль знакомит вас с механизмом полимеризации этилена в результате реакции присоединения свободных радикалов.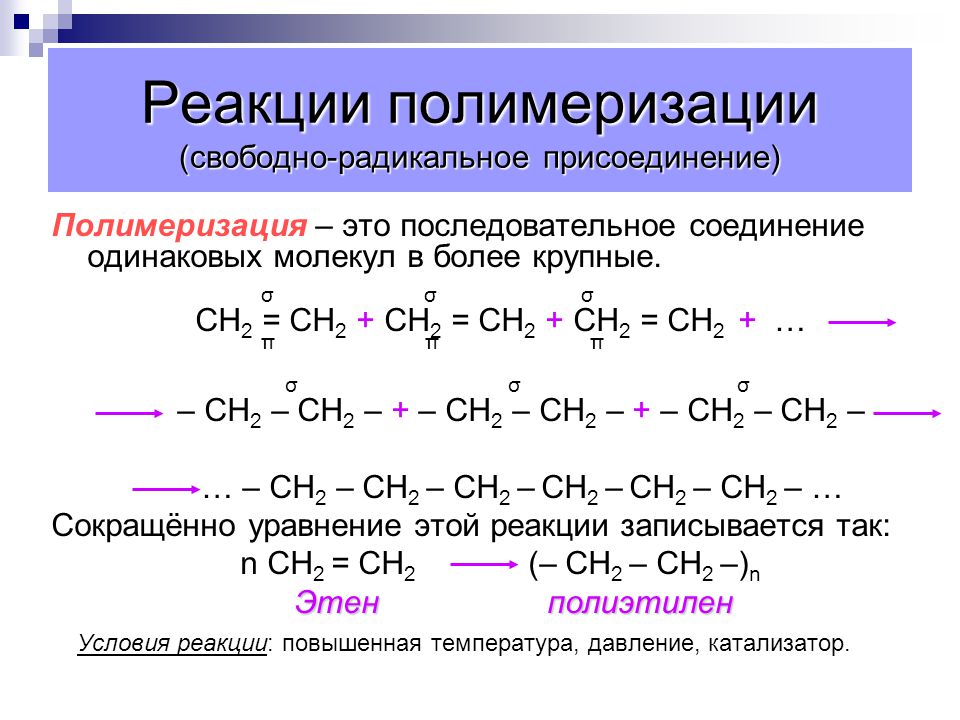 Мы собираемся очень подробно обсудить этот механизм, чтобы вы поняли, что происходит.
Мы собираемся очень подробно обсудить этот механизм, чтобы вы поняли, что происходит.
Реакция присоединения свободных радикалов
Вы помните, что во время полимеризации этена тысячи молекул этена соединяются вместе, образуя поли(этен), обычно называемый полиэтиленом. Реакцию проводят при высоком давлении в присутствии небольшого количества кислорода в качестве инициатора.
Стадия 1: Зарождение цепи
Кислород реагирует с некоторым количеством этена с образованием органического пероксида. Органические пероксиды представляют собой очень реакционноспособные молекулы, содержащие одинарные связи кислород-кислород, которые довольно слабы и легко разрушаются с образованием свободных радикалов. Вы можете сократить процесс, добавляя другие органические пероксиды непосредственно к этилену вместо использования кислорода, если хотите. Тип свободных радикалов, запускающих реакцию, зависит от их источника. Для простоты приведем им общую формулу: \(Ra ^{\bullet}\)
Этап 2: Распространение цепи
В молекуле этилена CH 2 =CH 2 две пары электронов, образующих двойную связь, не совпадают. Одна пара надежно удерживается на линии между двумя ядрами углерода в связи, называемой сигма-связью. Другая пара более свободно удерживается на орбитали выше и ниже плоскости молекулы, известной как \(\pi\)-связь.
Одна пара надежно удерживается на линии между двумя ядрами углерода в связи, называемой сигма-связью. Другая пара более свободно удерживается на орбитали выше и ниже плоскости молекулы, известной как \(\pi\)-связь.
Примечание
Было бы полезно, но не обязательно, если бы вы прочитали о структуре этен, прежде чем продолжить. Если приведенная выше диаграмма вам незнакома, то вам обязательно следует прочитать этот справочный материал.
Представьте, что произойдет, если свободный радикал приблизится к связи \(\pi\) в этилене.
Примечание
Не беспокойтесь, мы вернулись к более простой диаграмме. Пока вы понимаете, что пара электронов, показанная между двумя атомами углерода, находится в связи \(\pi\) — и, следовательно, уязвима — это все, что действительно имеет значение для этого механизма.
Ничто из этого не влияет на сигма-связь между атомами углерода. Свободный радикал Ra использует один из электронов в связи \(\pi\), чтобы помочь сформировать новую связь между собой и левым атомом углерода.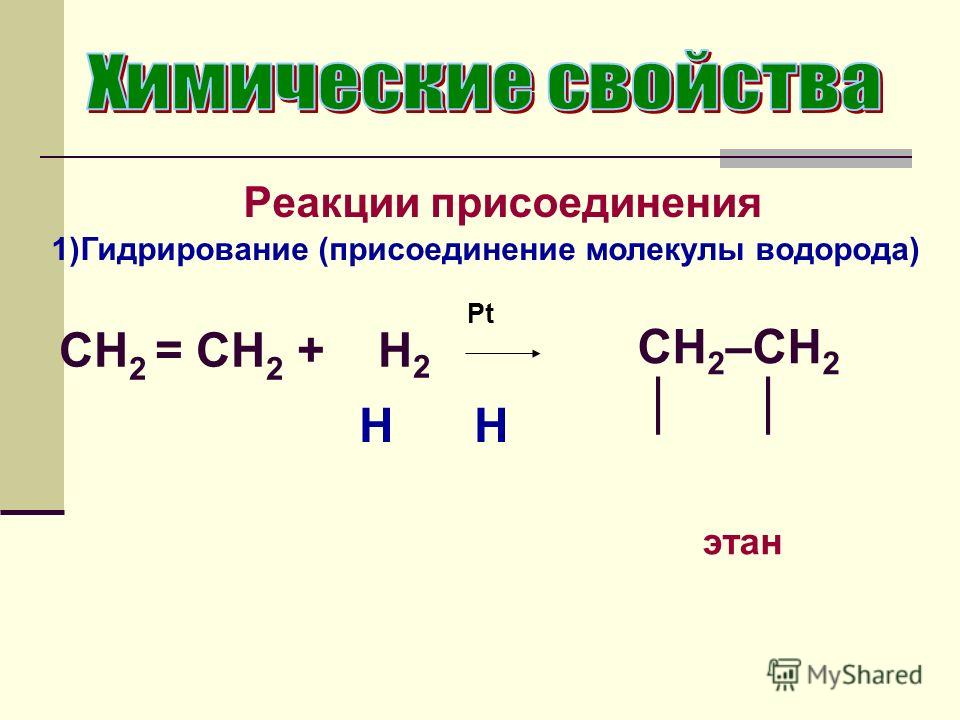 Другой электрон возвращается к правому углероду. Вы можете показать это, используя нотацию «фигурная стрелка», если хотите:
Другой электрон возвращается к правому углероду. Вы можете показать это, используя нотацию «фигурная стрелка», если хотите:
Примечание
Если вы не уверены в фигурных стрелках, вы можете перейти по этой ссылке.
Это энергетически целесообразно, потому что новая связь между радикалом и углеродом прочнее разорванной связи \(\pi\). При создании новой связи вы получите больше энергии, чем было потрачено на разрыв старой. Чем больше энергии выделяется, тем более стабильной становится система. Теперь у нас есть более крупный свободный радикал, удлиненный CH 9.0096 2 СН 2 . Это может реагировать с другой молекулой этилена таким же образом:
Так что теперь радикал еще больше. Тот может вступить в реакцию с другим этеном — и так далее, и тому подобное. Полимерная цепь становится все длиннее и длиннее.
Шаг 3: Завершение цепочки
Однако цепочка не растет бесконечно. Рано или поздно два свободных радикала столкнутся.
Это немедленно останавливает рост двух цепей и производит одну из последних молекул в полиэтилене. Важно понимать, что поли(этилен) будет смесью молекул разного размера, изготовленных случайным образом.
Резюме
Общий процесс известен как присоединение свободных радикалов.
- Цепь инициирование : Цепь инициируется свободными радикалами Ra, образующимися в результате реакции между некоторым количеством этена и кислородным инициатором.
- Распространение цепи : Каждый раз, когда свободный радикал сталкивается с молекулой этилена, образуется новый более длинный свободный радикал (например,
Поскольку обрыв цепи является случайным процессом, полиэтилен будет состоять из цепей разной длины.
Авторы
Джим Кларк (Chemguide.co.uk)
The Polymerization of Ethene распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.