Содержание
Производство аммиака в ЕГЭ по химии
Тема кодификатора ЕГЭ по химии: Общие научные принципы химического производства на примере промышленного получения аммиака, серной кислоты, метанола.
В этой статье мы рассмотрим принципы химического производства на примере получения аммиака в объеме, достаточном для решения заданий по этой теме в ЕГЭ по химии.
В промышленности аммиак получают по методу Габера – прямым взаимодействием азота и водорода в реакционной колонне:
N2 + 3Н2 ⇄ 2NH3
Реакция азота с водородом обратимая, экзотермическая, гомогенная (газофазная). Для увеличения выхода аммиака необходимо смещать равновесие в сторону продукта. Согласно принципу Ле-Шателье, для смещения равновесия вправо в данной реакции необходимо повышать давление и понижать температуру. Однако низкая температура уменьшит скорость реакции.
Однако низкая температура уменьшит скорость реакции.
Поэтому для повышения скорости реакции температура в процессе поддерживается все-таки высокой, 500-550оС и в присутствии катализатора.
А для смещения равновесия применяют очень высокие давления 15-30 МПа.
В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
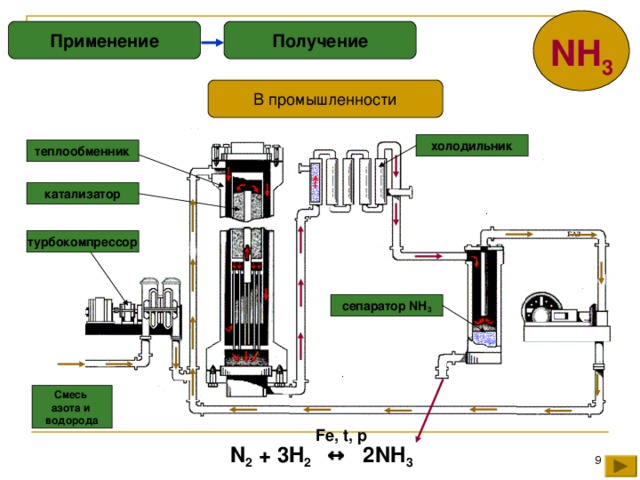
Рассмотрим процессы, протекающие на разных участках производства аммиака:
1 этап. Трубопровод. В трубопровод подается предварительно подготовленная азотно-водородная смесь (N2:Н2=1:3) в соотношении 1 к 3.
2 этап. Турбокомпрессор.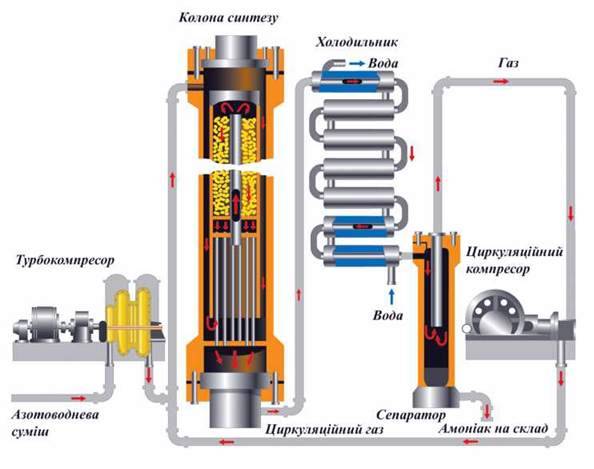 Турбокомпрессор используется для сжатия исходной смеси газов с целью повышения давления. Синтез аммиака проводится при очень высоком давлении (15-30 МПа, или 150-300 атм).
Турбокомпрессор используется для сжатия исходной смеси газов с целью повышения давления. Синтез аммиака проводится при очень высоком давлении (15-30 МПа, или 150-300 атм).
3 этап. Колонна синтеза. В колонне синтеза (контактном аппарате) производится синтез аммиака. Азотно-водородная смесь продавливается через полки с катализатором. Процесс синтеза протекает обратимо (т.е. частично) и является сильно экзотермическим, протекает с большим выделением тепла. Часть выделяющегося тепла расходуется на нагревание поступающей азотоводородной смеси с помощью теплообменников. Смесь, выходящая из колонны синтеза в холодильник, состоит из аммиака (20-30%) и не прорегировавших азота и водорода.
4 этап. Холодильник. В холодильнике реакционная смесь, которая выходит из колонны синтеза, охлаждается и направляется на дальнейшее разделение в сепаратор.
5 этап.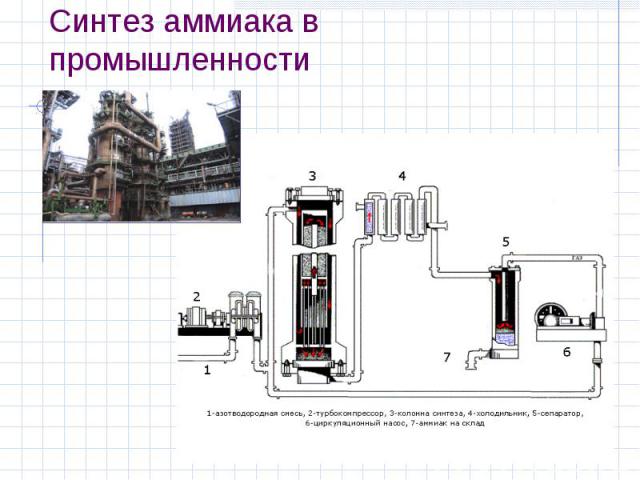 Сепаратор. После прохождения холодильника температура реакционной смеси значительно снижается, и аммиак переходит в жидкую фазу. В сепараторе происходит разделение реакционной смеси, жидкий аммиак отделяют от азота и водорода и отправляют на склад.
Сепаратор. После прохождения холодильника температура реакционной смеси значительно снижается, и аммиак переходит в жидкую фазу. В сепараторе происходит разделение реакционной смеси, жидкий аммиак отделяют от азота и водорода и отправляют на склад.
6 этап. Циркуляционный насос. Циркуляционный насос возвращает не прореагировавшую смесь азота и водорода в контактный аппарат. Благодаря циркуляции удаѐтся довести использование азотводородной смеси (конверсию) до 95%.
Понравилось это:
Нравится Загрузка…
Как получают аммиак в промышленности и где используется, какой класс опасности. Читайте в блоге «ТАНТАЛ-Д»
Автор статьи
Лебедев Юрий Агафонович
Дата публикации:
01.02.2022
Дата обновления:
30.11.2022
Заместитель директора
Работает в отрасли
c 1999 г.
Вещество, распространенное в большей мере в форме резко пахнущего бесцветного газа, и представляющее собой нитрид водорода, широко известно как аммиак. Сферы его применения разнообразны. Химическое соединение используют для изготовления удобрений с азотом, соды, взрывчатых веществ, полимерных составов и иных промышленных продуктов. В жидкой форме вещество применяют как растворитель, в твердой оно представляет собой кубические кристаллы. В его составе один атом азота и три — водорода.
Сферы его применения разнообразны. Химическое соединение используют для изготовления удобрений с азотом, соды, взрывчатых веществ, полимерных составов и иных промышленных продуктов. В жидкой форме вещество применяют как растворитель, в твердой оно представляет собой кубические кристаллы. В его составе один атом азота и три — водорода.
Синтетический аммиак незаменим в производстве азотных удобрений.
Вячеслав Жвирблис
Содержание статьи
- Производство
- К какому классу веществ относится аммиак
- Области применения аммиака
- в производстве
- в холодильных установках
- в медицине
Длительное воздействие аммиачного газа представляет опасность для человека, потому что вызывает отек легких и угнетение нервной системы. Опасность повышает отсутствие запаха у вещества.
Опасность повышает отсутствие запаха у вещества.
Из этой статьи вы подробнее узнаете о том, где используют аммиак, как его получают в промышленности, как выглядит химическая формула, где используется в медицине, в производстве, к какому классу опасности относится аммиак.
Производство
Ежегодно в мире химические предприятия выпускают порядка 180 миллионов тонн аммиака. Как образуется аммиак? В результате непосредственного соединения водорода и азота, при протекании химической реакции с выделением тепла:
N2 + 3NH3 + 91,84 кДж
Наибольший выход аммиака 30% достигается при температуре 500°C и давлении в 350 атмосфер, притом для протекания реакции используют катализатор — пористое железо с оксидом калия. Из чего делают аммиак на производстве, на заводе? Его синтезируют из азота и водорода при высокой температуре. К молекуле двухатомного азота добавляют три двухатомные молекулы водорода.
К какому классу веществ относится аммиак
Согласно классификации ГОСТ 12. 1.007, данное вещество относится к малоопасным веществам и принадлежит к четвертому классу опасности.
1.007, данное вещество относится к малоопасным веществам и принадлежит к четвертому классу опасности.
Оно хорошо растворяется в воде. В жидкой форме оно почти не проводит ток и сильно преломляет свет. Его запах ощутим, если концентрация аммиачных паров достигает 37 мг/м³.
Области применения аммиака
В производстве
Из аммиака изготавливают азотсодержащие удобрения, полимеры, соду. Его используют как противоморозный компонент строительной смеси, а также для придания аромата цветам без запаха или для изменения их окраски.
В холодильных установках
Где еще используется аммиак? В системах охлаждения. Он служит хладагентом. В том числе с его помощью охлаждают каналы энергоснабжения МКС.
В медицине
Используется для нанесения на поверхность кожи, ингаляций и приема внутрь, для приведения в сознание человека при обмороке. Аммиак применяют при укусах насекомых, невралгии, для повышения давления, для очищения поверхностей, в том числе рук хирурга.
Какая формула у аммиака
Формула вещества — NH3. Его молекула представляет собой пирамиду, где в основании атомы водорода, а наверху — атом азота.
Свойства NH₃
Аммиак — комплексообразователь. Его раствор, известный как нашатырь, обладает слабощелочной реакцией. При взаимодействии с кислотами, производит соли аммония. Вещество также слабая кислота. Взаимодействуя с металлами, оно образует соли.
Аммиачные растворы амидов — проводники тока. Нагреваясь, аммиак разлагается. Вещество горит в атмосфере кислорода, продукты горения — вода и азот. Хлор и йод под воздействием аммиака формируют взрывчатые вещества. При температуре 1000°C NH3 реагирует с углем, в результате образуется синильная кислота. Аммиак реагирует и с метаном, продукт реакции тот же.
Воздействие аммиака на физиологию
Для живого организма аммиак опасен своей токсичностью. Он действует удушающе, оказывает нейротропный эффект. При ингаляционном воздействии может провоцировать отек легких, угнетать нервную систему. У вещества местное и резорбтивное действие.
У вещества местное и резорбтивное действие.
Воздействие паров NH3 приводит к раздражению слизистой и кожи. Такое раздражение воспринимается рецепторами как резкий запах, проявляется слезотечением, потерей зрения вследствие химического ожога, кашлем, зудом. Если сжиженный аммиак касается кожи, ее обжигает, на ней могут появиться пузыри. Испаряясь, он поглощает тепло, а касаясь кожного покрова при испарении, вызывает обморожение.
На производстве допустима максимальная концентрация аммиака в воздушной массе 20 мг/м³. Предельная среднесуточная концентрация вещества в помещении — 0,04 мг/м³. Допустима разовая концентрация аммиака в воздухе — 0,2 мг/м³. Если нормы превышаются, то в воздухе ощущается запах аммиака.
Когда в воздухе содержится 280 мг/м³, то раздражается зев, 490 мг/м³ — глаза, от 7 г/м³ — кожный покров. Легкие отекают, если аммиак в концентрации 1,5 г/м³ воздействует на человека в течение часа. Если кратковременно воздействовать аммиаком с содержанием в воздухе от 3,5 г/м³, то неизбежны общетоксические поражения.
Хотите получить консультацию?
Позвоните нам по телефону!
+7 (495) 532 17 17 Пн.-Пт. с 9:00 до 18:00, обед с 13:00 до 14.00, Сб. с 9.00 до 15:00
Некоторые факты об аммиаке
- Пары нашатырного спирта (раствора аммиака в воде) могут менять окраску цветов. Лепестки синих оттенков они делают зелеными, насыщенно-красные — чернят.
- Аммиак наполняет облака над Юпитером.
- Не пахнущие в естественной среде цветы после воздействия на них аммиаком источают приятный аромат. К таким цветам относятся астры.
- Нашатырь, взаимодействуя с йодом, образует йодистый азот в виде кристаллов, таким образом проводят химические опыты с наглядными результатами.
Источники:
- https://ru.wikipedia.org/wiki/Аммиак
- Общая и неорганическая химия. Н. С. Ахметов
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
Как образуется аммиак?
При соединении водорода и азота.
Аммиак — это опасное вещество?
По классификации ГОСТ 12.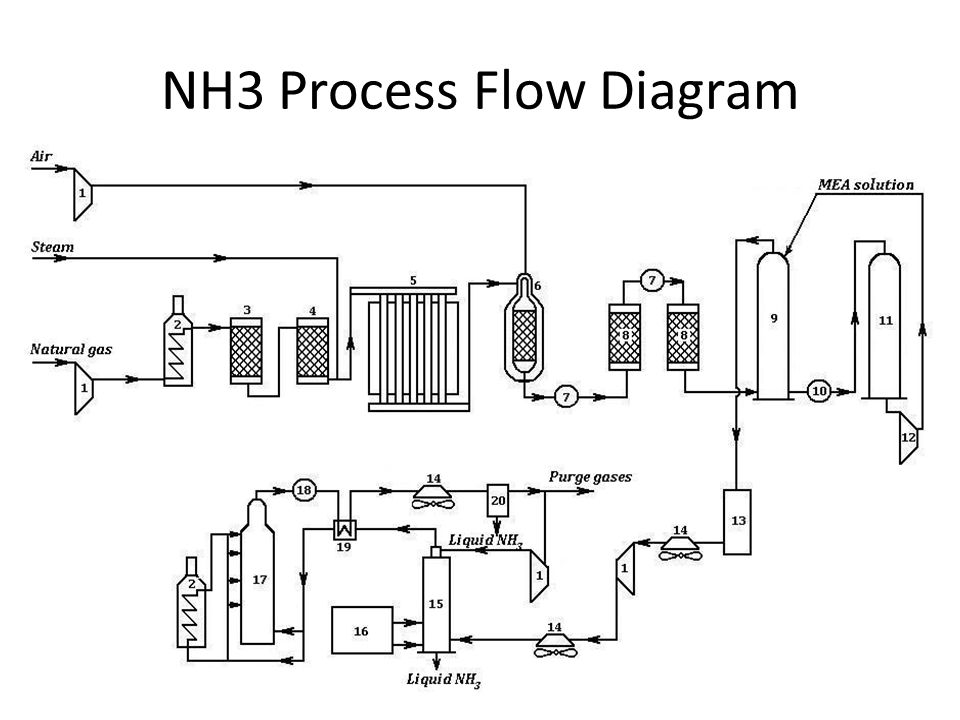 1.007 это вещество признается малоопасным.
1.007 это вещество признается малоопасным.
Где применяют аммиак?
Для производства удобрений, полимеров, соды, в холодильных установках, медицине и других сферах.
Как аммиак действует на человека?
Пары аммиака раздражают слизистую и кожу, возможен химический ожог. При длительном вдыхании провоцируют отек легких и удушье.
Если вам понравилась статья, поделитесь ей в социальных сетях
Введение в производство аммиака | AIChE
Аммиак играет решающую роль в производстве удобрений и является одним из крупнейших синтетических химикатов, производимых в мире. В этой статье исследуется эволюция производства аммиака и описываются современные технологии производства.
У большинства людей резкий запах аммиака (NH 3 ) ассоциируется с чистящими средствами или нюхательными солями. Однако использование аммиака в этих двух продуктах составляет лишь небольшую часть от общего объема производства аммиака в мире, который в 2014 году составил около 176 миллионов метрических тонн9. 0009 (1) . Чтобы понять, где сегодня находятся промышленность и технологии, давайте сначала посмотрим, как мы к этому пришли.
0009 (1) . Чтобы понять, где сегодня находятся промышленность и технологии, давайте сначала посмотрим, как мы к этому пришли.
Аммиак известен уже более 200 лет. Джозеф Пристли, английский химик, впервые выделил газообразный аммиак в 1774 году. Его состав был установлен французским химиком Клодом Луи Бертолле в 1785 году. В 1898 году Адольф Франк и Никодем Каро обнаружили, что N 2 может фиксироваться карбидом кальция с образованием кальция. цианамид, который затем можно гидролизовать водой с образованием аммиака (2) :
CAO + 3C ↔ CAC 2 + CO
CAC 2 + N 2 ↔ CACN 2 + C
CACN 2 + 3H 2 o ↔ CACO CACN 2 + 3H 2 o ↔ CACO CACN 3 + 2NH 3
Производство значительных количеств аммиака с использованием цианамидного процесса не производилось до начала 20 века. Поскольку этот процесс требует большого количества энергии, ученые сосредоточили свои усилия на снижении потребности в энергии.
Немецкий химик Фриц Габер выполнил одну из самых важных работ в развитии современной аммиачной промышленности. Работа со студенткой в Univ. Карлсруэ он синтезировал аммиак в лаборатории из N 2 и H 2 .
Между тем, Вальтер Нернст, профессор физической химии в Univ. из Берлина разработал процесс получения аммиака пропусканием смеси N 2 и H 2 через железный катализатор при 1000°C и манометрическом давлении 75 бар. Он смог произвести большее количество аммиака при этом давлении, чем более ранние эксперименты Габера и других при атмосферном давлении. Однако Нернст пришел к выводу, что этот процесс неосуществим, потому что было трудно или почти невозможно (в то время) производить крупногабаритное оборудование, способное работать при таком давлении.
Тем не менее, и Хабер, и Нернст использовали метод высокого давления для производства аммиака на катализаторе. Наконец, Габер разработал процесс производства аммиака в коммерческих количествах, и в 1906 году ему удалось достичь концентрации аммиака 6% в реакторе, загруженном осмиевым катализатором. Это общепризнано как поворотный момент в разработке практического способа производства аммиака в промышленных количествах.
Это общепризнано как поворотный момент в разработке практического способа производства аммиака в промышленных количествах.
Хабер понял, что количество аммиака, образующегося за один проход через конвертер, слишком мало, чтобы представлять коммерческий интерес. Чтобы производить больше аммиака из подпиточного газа, он предложил систему рециркуляции и получил патент на эту концепцию. Идея рециркуляции Хабера изменила представление о разработке процессов как о статике в пользу более динамичного подхода. Помимо равновесия химической реакции, Габер признал, что определяющим фактором является скорость реакции. Вместо простого выхода в прямом процессе он сосредоточился на объемно-временном выходе в системе с рециркуляцией.
BASF приобрела патенты Хабера и начала разработку коммерческого процесса. После испытаний более 2500 различных катализаторов Карл Бош, Элвин Митташ и другие химики BASF в 1910 году разработали промотированный железный катализатор для производства аммиака. Разработка оборудования, способного выдерживать необходимые высокие температуры и давление, была еще более сложной задачей. Первый реактор из мягкой стали проработал всего 80 часов до выхода из строя из-за декарбонизации. Футеровка реакторов из мягкой стали мягким железом (которое не подвержено обезуглероживанию) и добавление канавок между двумя вкладышами для выпуска водорода, который диффундировал через вкладыш из мягкого железа, решили эту проблему. Другие серьезные проблемы включали разработку теплообменника для доведения входящего газа до температуры реакции и охлаждения выходящего газа, а также разработку метода доведения катализатора до температуры реакции.
Первый реактор из мягкой стали проработал всего 80 часов до выхода из строя из-за декарбонизации. Футеровка реакторов из мягкой стали мягким железом (которое не подвержено обезуглероживанию) и добавление канавок между двумя вкладышами для выпуска водорода, который диффундировал через вкладыш из мягкого железа, решили эту проблему. Другие серьезные проблемы включали разработку теплообменника для доведения входящего газа до температуры реакции и охлаждения выходящего газа, а также разработку метода доведения катализатора до температуры реакции.
Первая коммерческая установка по производству аммиака, основанная на процессе Габера-Боша, была построена компанией BASF в Оппау, Германия. Завод был запущен 9 сентября 1913 года с производственной мощностью 30 тонн в сутки.
▲ Рис. 1. Это упрощенная технологическая схема первого коммерческого завода по производству аммиака BASF.
На рис. 1 представлена технологическая схема первого коммерческого завода по производству аммиака. Реактор содержал внутренний теплообменник в дополнение к показанным на схеме.
Реактор содержал внутренний теплообменник в дополнение к показанным на схеме.
Глобальные темпы производства
▲ Рисунок 2. Производство аммиака в мире неуклонно росло с 1946 по 2014 год.
Производство аммиака стало одной из важнейших отраслей промышленности в мире. Без урожая, который стал возможен благодаря удобрениям и химикатам на основе аммиака, население мира было бы по крайней мере на два-три миллиарда меньше, чем сегодня (3) . Производство аммиака неуклонно растет с 1946 года (рис. 2), и, по оценкам, годовой объем производства аммиака составляет более 100 миллиардов долларов, при этом некоторые заводы производят более 3000 тонн NH 9 в день.0007 3 .
В 1983 году, по случаю 75-летия со дня основания AIChE, группа выдающихся инженеров-химиков с голубой лентой назвала то, что они считали десятью величайшими мировыми достижениями в области химической инженерии (4) . Охватывая такие достижения, как чудо-лекарства, синтетические волокна и атомная энергия, цитата также включала прорыв, позволивший производить большое количество аммиака на компактных одноблочных установках.
За последние десятилетия инженеры-химики преуспели в создании процессов, позволяющих производить огромное количество аммиака при относительно низких затратах. Еще 80 лет назад общий годовой объем производства синтезированного аммиака составлял чуть более 300 000 тонн. Благодаря прорывам в химической технологии один современный завод по производству аммиака может производить более 750 000 т/год.
Приблизительно 88% ежегодно производимого аммиака расходуется на производство удобрений. Большая часть остатка идет на производство формальдегида. Китай произвел около 32,6% мирового производства в 2014 году, в то время как Россия, Индия и США произвели 8,1%, 7,6% и 6,4% соответственно (1) . В то время как большая часть мирового производства аммиака основана на паровой конверсии природного газа, значительные количества производятся путем газификации угля; большая часть газификационных заводов находится в Китае.
Современные производственные процессы
Огромный рост потребности в аммиаке с 1950 по 1980 год потребовал более крупных и энергоэффективных заводов. В эти десятилетия также произошли изменения в философии дизайна. До этого времени аммиачный завод рассматривался как совокупность не связанных между собой агрегатов, таких как газоподготовка, газоочистка, компримирование газа и синтез аммиака. Новые инновации и целостный дизайн объединили технологические блоки наиболее эффективным и действенным образом.
В эти десятилетия также произошли изменения в философии дизайна. До этого времени аммиачный завод рассматривался как совокупность не связанных между собой агрегатов, таких как газоподготовка, газоочистка, компримирование газа и синтез аммиака. Новые инновации и целостный дизайн объединили технологические блоки наиболее эффективным и действенным образом.
▲ Рисунок 3. Компания KBR спроектировала один из первых крупнотоннажных заводов по производству аммиака с одной линией.
В середине 1960-х годов компания American Oil Co. установила завод по производству аммиака с одним конвертером, спроектированный MW Kellogg (MWK) в Техас-Сити, штат Техас, мощностью 544 мт/день. Концепция конструкции с одной линией (рис. 3) была настолько революционной, что в 1967 г. она была удостоена награды Киркпатрика за достижения в области химического машиностроения.
На заводе использовался четырехкорпусный центробежный компрессор для сжатия до рабочего давления 324 бар произошло в поршневом компрессоре. Также были внедрены центробежные компрессоры для контура синтеза и холодильного оборудования, что обеспечило значительную экономию средств.
Также были внедрены центробежные компрессоры для контура синтеза и холодильного оборудования, что обеспечило значительную экономию средств.
Основные различия между процессом MWK и процессами, использовавшимися на предыдущих установках по производству аммиака, включали:
- использование центробежного компрессора как части сжатия синтез-газа отработанное тепло для использования в приводах паровых турбин
- с использованием холодильного компрессора для выбега и атмосферного охлаждения.
Интегрированная схема, которая уравновешивала потребление энергии, производство энергии, размер оборудования и объемы катализатора, была внедрена на всем предприятии.
Большинство заводов, построенных между 1963 и 1993 годами, имели большие однолинейные конструкции с производством синтез-газа при 25–35 бар и синтезом аммиака при 150–200 бар. Другой вариант от Braun (теперь KBR) предлагал небольшие модификации базовой конструкции. В технологических установках Braun Purifier использовалась первичная или трубчатая установка риформинга с низкой температурой на выходе и высокой утечкой метана для уменьшения размера и стоимости установки риформинга. В установку вторичного риформинга добавляли избыток воздуха, чтобы снизить содержание метана в выходящем потоке установки первичного риформинга до 1–2%. Избыточный азот и другие примеси удаляли после метанатора. Поскольку синтез-газ практически не содержал примесей, для достижения высокой конверсии аммиака использовали два конвертера аммиака с осевым потоком.
В установку вторичного риформинга добавляли избыток воздуха, чтобы снизить содержание метана в выходящем потоке установки первичного риформинга до 1–2%. Избыточный азот и другие примеси удаляли после метанатора. Поскольку синтез-газ практически не содержал примесей, для достижения высокой конверсии аммиака использовали два конвертера аммиака с осевым потоком.
Некоторые недавно построенные заводы имеют систему производства синтез-газа только с одним риформером (без вторичного риформинга), систему адсорбции при переменном давлении (PSA) для извлечения H 2 и воздухоразделительную установку в качестве источника N 2 . Улучшения в конструкции конвертера, такие как радиальные и горизонтальные слои катализатора, внутренние теплообменники и обработка синтез-газа, помогли увеличить концентрацию аммиака на выходе из конвертера синтеза примерно с 12% до 19–21%. Более высокая конверсия за проход, а также более эффективные турбины и компрессоры еще больше снизили потребление энергии.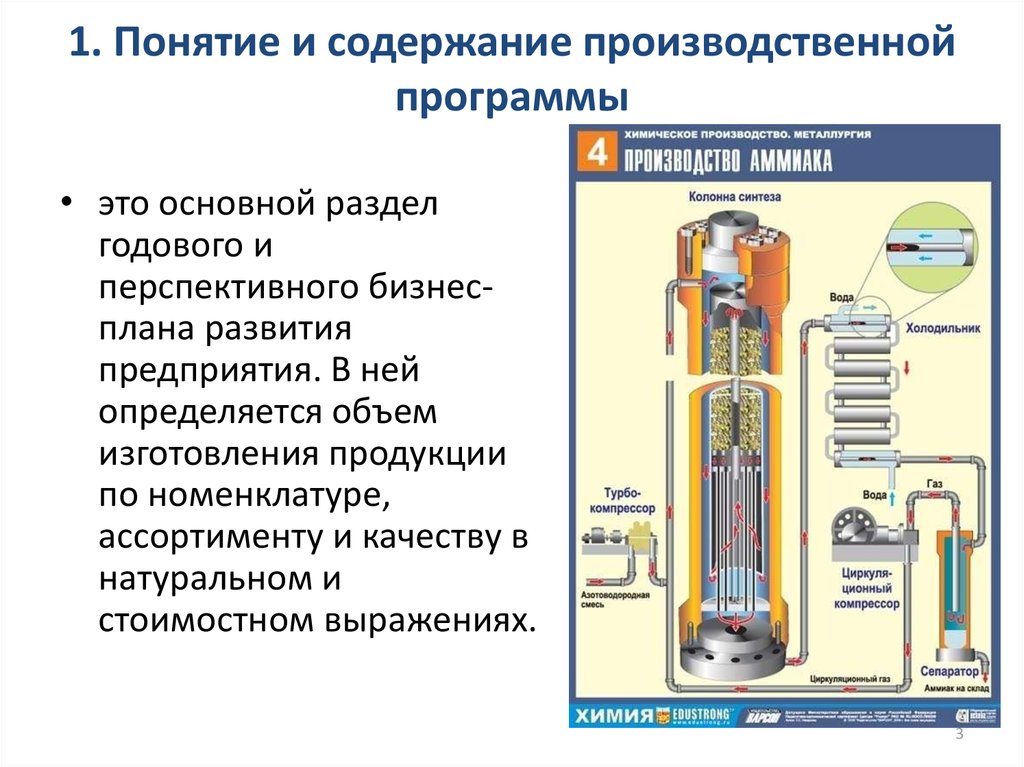 Более эффективный CO 2 растворы для удаления, такие как карбонат калия и метилдиэтаноламин (МДЭА), способствовали повышению энергоэффективности. Большинство современных заводов могут производить аммиак с потреблением энергии 28 ГДж/м.т.
Более эффективный CO 2 растворы для удаления, такие как карбонат калия и метилдиэтаноламин (МДЭА), способствовали повышению энергоэффективности. Большинство современных заводов могут производить аммиак с потреблением энергии 28 ГДж/м.т.
Помимо конструктивных, механических и металлургических усовершенствований, выполненных за это время, было значительно снижено рабочее давление контура синтеза. Когда в 1960-х годах была построена первая однолинейная установка, она содержала контур синтеза высокого давления. В 1962, MWK получила запрос от Imperial Chemical Industries (ICI) на предложение построить завод мощностью 544 тонны в день на своей площадке в Севернсайде. MWK предложила цикл синтеза на 152 такта вместо цикла на 324 такта.
Поскольку разработка кинетических данных для реакции с аммиаком при 152 бар заняла бы больше времени, чем MWK должна была ответить на запрос ICI, они связались с Haldor Topsøe, чтобы поддержать их планы. Топсе располагал данными, охватывающими весь интересующий MWK диапазон давлений. Кроме того, у них была компьютерная программа для расчета количества катализатора, необходимого при более низком рабочем давлении. Несмотря на то, что ICI выбрала Bechtel для проектирования завода, MWK смогла разработать технологическую схему для проекта мощностью 544 т/сутки с центробежными компрессорами и контуром синтеза низкого давления, что некоторые считают самым важным событием в разработке завода. однолинейный аммиачный завод.
Кроме того, у них была компьютерная программа для расчета количества катализатора, необходимого при более низком рабочем давлении. Несмотря на то, что ICI выбрала Bechtel для проектирования завода, MWK смогла разработать технологическую схему для проекта мощностью 544 т/сутки с центробежными компрессорами и контуром синтеза низкого давления, что некоторые считают самым важным событием в разработке завода. однолинейный аммиачный завод.
Примерно в два раза больше катализатора требовалось при 152 бар, чем при 324 бар, что казалось экономически целесообразным. Хотя преобразователю потребуется вдвое больший объем, более низкое рабочее давление уменьшит требуемую толщину кожуха высокого давления. В результате масса металла, необходимая для конвертера плюс катализатор, осталась примерно такой же. Контур синтеза более низкого давления также позволял использовать центробежные компрессоры вместо поршневых компрессоров. Еще одним усовершенствованием стала рекуперация тепла для производства пара высокого давления для приводов паровых турбин.
Проекты заводов в 21 веке
В течение первых нескольких лет 21 века в технологии заводов по производству аммиака было внесено множество усовершенствований, которые позволяют увеличивать производительность существующих заводов и строить новые заводы с большей и большей производительностью. Конкуренция между поставщиками технологий достаточно жесткая. В настоящее время на рынке доминируют три лицензиара технологий — KBR (Kellogg Brown and Root), Haldor Topsøe и ThyssenKrupp Industrial Solutions (TKIS). Компания Ammonia Casale, предлагающая аксиально-радиальную конструкцию слоя катализатора, является лидером на рынке реконструкции существующих установок.
▲ Рис. 4. Современные установки по производству аммиака, разработанные KBR, используют очиститель собственной конструкции.
Большинство заводов по производству аммиака, недавно спроектированных KBR, используют процесс Purifier (рис. 4), который сочетает в себе риформинг низкой жесткости в установке первичного риформинга, очиститель жидкого азота 2 после метанатора для удаления примесей и регулирования H 2 :N 2 , запатентованная конструкция котла-утилизатора, агрегатированный чиллер и горизонтальный конвертер синтеза аммиака.
В зависимости от конфигурации установки потребление энергии может составлять всего 28 ГДж/м.т. Поскольку в установке вторичного риформинга используется избыточный воздух, установка первичного риформинга может быть меньше, чем в обычных конструкциях. Криогенный очиститель (показан на рис. 4 светло-зеленым цветом на светло-оранжевом фоне), состоящий из детандера, конденсатора, теплообменника исходного/выходящего потока и ректификационной колонны, удаляет примеси, такие как CO, CH 4 и аргон, из синтез-газа при регулировке H 2 :N 2 соотношение подпиточного газа в контуре аммиака до оптимального уровня. Концентрация аммиака на выходе из горизонтального конвертера с низким перепадом давления составляет 20–21 %, что снижает энергозатраты на циркуляционный компрессор. KBR также предлагает аммиачную петлю низкого давления, в которой используется комбинация магнетитового катализатора и запатентованного рутениевого катализатора.
▲ Рис. 5. Haldor Topsøe предлагает конструкцию завода по производству аммиака с запатентованной установкой риформинга с боковым нагревом, в которой радиационные горелки подают тепло для реакции риформинга.
5. Haldor Topsøe предлагает конструкцию завода по производству аммиака с запатентованной установкой риформинга с боковым нагревом, в которой радиационные горелки подают тепло для реакции риформинга.
Секция производства синтез-газа (или передняя часть) завода, спроектированного компанией Haldor Topsøe (рис. 5), довольно традиционна, за исключением собственной установки риформинга с боковым обогревом, в которой для подачи тепла для реакции риформинга используются радиационные горелки. Haldor Topsøe также предлагает запатентованный катализатор синтеза на основе железа, радиальные конвертеры, состоящие из одного, двух или трех слоев, и запатентованный байонетно-трубный котел-утилизатор. Более поздние разработки включают конструкции преобразователей С-300 и С-350. Конвертер S-300 представляет собой трехслойную конфигурацию с радиальным потоком и внутренними теплообменниками, а конструкция S-350 сочетает в себе конвертер S-300 с однослойной конструкцией S-50 с рекуперацией отработанного тепла между конвертерами для максимизации аммиака.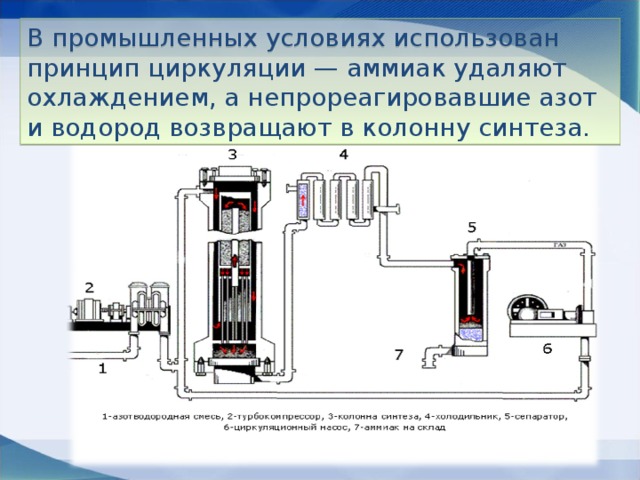 преобразование.
преобразование.
▲ Рис. 6. Конструкция контура синтеза двойного давления ThyssenKrupp включает прямоточный реактор между компрессорами синтез-газа.
ThyssenKrupp предлагает обычную установку (рис. 6) с уникальной конструкцией установки вторичного риформинга, запатентованным котлом-утилизатором, радиальными преобразователями и контуром синтеза аммиака двойного давления. Сегодня производительность 3300 мт/день может быть достигнута с использованием процесса двойного давления TKIS.
▲ Рис. 7. Концепция аммиака Linde (LAC) включает установку адсорбции при переменном давлении для производства водорода высокой чистоты и установку разделения воздуха для производства азота высокой чистоты.
Концепция Linde по производству аммиака (LAC) представляет собой устоявшуюся схему технологического процесса, основанную на более чем 25-летнем опыте эксплуатации установок производительностью от 200 т/сут до более 1750 т/сут. Технологическая схема LAC (рисунок 7) заменяет дорогостоящую и сложную входную часть традиционной аммиачной установки двумя хорошо зарекомендовавшими себя надежными технологическими установками:
- производство водорода сверхвысокой чистоты из установки парометанового риформинга с очисткой PSA
- производство азота сверхвысокой чистоты с помощью криогенной установки для производства азота, также известной как воздухоразделительная установка (ВРУ).

▲ Рисунок 8. В процессе Ammonia Casale используется слой катализатора, использующий аксиально-радиальную технологию, которая обеспечивает более низкий перепад давления и более высокую эффективность, чем стандартные слои катализатора.
Проект завода по производству аммиака Casale рассчитан на производительность 2000 мт/день. Одной из ключевых особенностей этой конструкции является аксиально-радиальная технология в слое катализатора (рис. 8). В аксиально-радиальном слое катализатора большая часть синтез-газа проходит через слой катализатора в радиальном направлении, создавая очень низкий перепад давления. Остальной газ проходит вниз через верхний слой катализатора в осевом направлении, что устраняет необходимость в верхней крышке слоя катализатора. Технология аксиально-радиального слоя катализатора Casale используется как в высокотемпературных, так и в низкотемпературных конвертерах конверсии, а также в конвертере синтеза.
Другие технологии
Некоторые поставщики технологий предложили установки риформинга с газовым обогревом (GHR) для производства аммиака на установках малой мощности или для увеличения мощности. В отличие от установок традиционной конструкции, в которых используется установка первичного риформинга и установка вторичного риформинга, работающие последовательно, установки с GHR используют горячий технологический газ из установки вторичного риформинга для подачи тепла в установку первичного риформинга. Это уменьшает размер установки первичного риформинга и устраняет выбросы CO 2 из дымовой трубы установки первичного риформинга, что делает процесс более безопасным для окружающей среды.
В отличие от установок традиционной конструкции, в которых используется установка первичного риформинга и установка вторичного риформинга, работающие последовательно, установки с GHR используют горячий технологический газ из установки вторичного риформинга для подачи тепла в установку первичного риформинга. Это уменьшает размер установки первичного риформинга и устраняет выбросы CO 2 из дымовой трубы установки первичного риформинга, что делает процесс более безопасным для окружающей среды.
Несмотря на то, что некоторые производители аммиака выступают за распределенное производство аммиака на небольших аммиачных заводах, большинство компаний предпочитают строить крупные предприятия рядом с источниками дешевого сырья и транспортировать продукт к потребителям морским, железнодорожным или трубопроводным транспортом.
Аммиак из угля
▲ Рисунок 9. Китай производит большую часть аммиака из угля.
Китай производит больше аммиака, чем любая другая страна, и большую часть аммиака производит из угля (рис.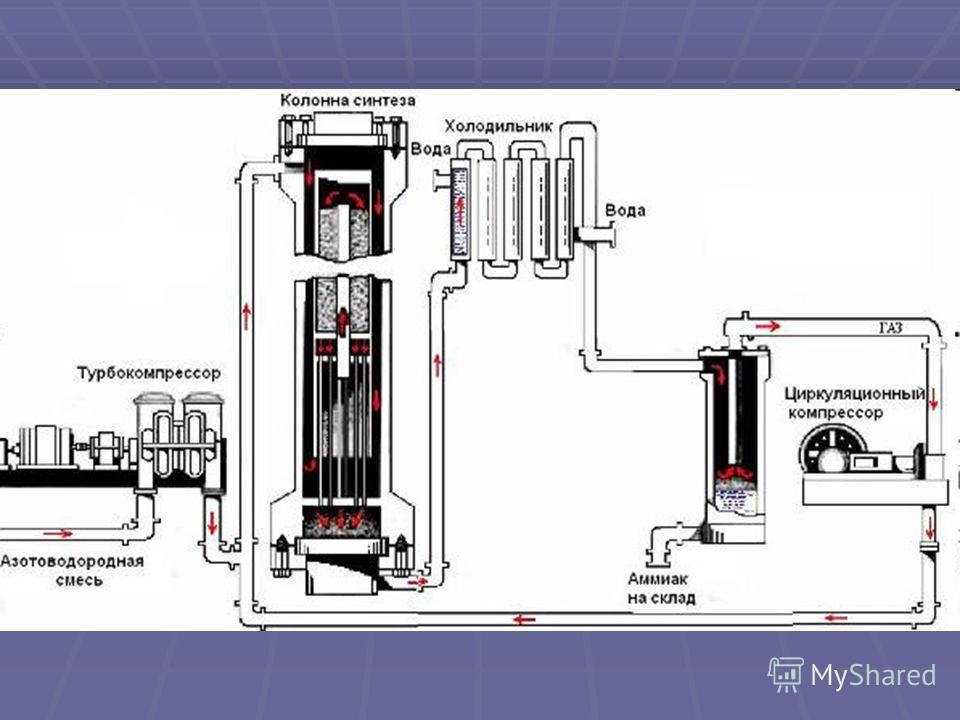 9).).
9).).
Основными технологическими установками на угольном аммиачном заводе являются ВРУ отделения О 2 и N 2 от воздуха, газификатор, установка конверсии сырых газов (СГС), установка очистки кислых газов ( АГРУ) и установка синтеза аммиака. Кислород из ВРУ подают в газификатор для преобразования угля в синтез-газ (H 2 , CO, CO 2 ) и CH 4 . Существует множество конструкций газификаторов, но большинство современных газификаторов основаны на псевдоожиженных слоях, которые работают при давлении выше атмосферного и могут использовать различное угольное сырье. В зависимости от конструкции могут быть получены уровни CO 30–60% по объему.
После газификации любые твердые частицы из синтез-газа удаляются, и в установку SGS добавляется пар. В процессе SGS обычно используется катализатор на основе кобальта и молибдена (CoMo), специально разработанный для работы в среде серы.
После снижения концентрации CO в синтез-газе до уровня менее 1 об. % синтез-газ направляется в AGRU, где охлажденный метанольный скрубберный раствор ( например, Rectisol) удаляет CO 2 и серу из синтез-газа . СО 2 верхние погоны либо вентилируются, либо подаются на завод по производству мочевины. Выходящий поток серы направляется на установку извлечения серы (SRU).
% синтез-газ направляется в AGRU, где охлажденный метанольный скрубберный раствор ( например, Rectisol) удаляет CO 2 и серу из синтез-газа . СО 2 верхние погоны либо вентилируются, либо подаются на завод по производству мочевины. Выходящий поток серы направляется на установку извлечения серы (SRU).
Синтез-газ, который проходит через AGRU, обычно очищается одним из двух методов:
- установка промывки азотом для удаления остаточного CO и CH 4 из синтез-газа перед его подачей в контур синтеза
- система PSA для Удаление CO и CH 4 .
Заключение
За последние 60 лет технология производства аммиака значительно улучшилась. Компоновки заводов эволюционировали от конструкций с несколькими линиями, часто с разным количеством линий на входе и в контуре синтеза, к конструкциям с одной линией. Подготовка синтез-газа в передней части установки увеличилась с атмосферного давления до манометрического давления 30–50 бар. Пропускная способность увеличилась со 100 мт/день до 3300 мт/день на одном поезде.
Пропускная способность увеличилась со 100 мт/день до 3300 мт/день на одном поезде.
Энергоэффективность также улучшилась — потребление значительно превысило 60 ГДж/м.т. аммиака на коксохимических заводах до 40–50 ГДж/м.т. на первых заводах, работающих на природном газе, до 30–40 ГДж/м.т. на первых однолинейных заводах. Современные заводы добавили рекуперацию тепла за счет производства пара при давлении до 125 бар как в секции подготовки синтез-газа, так и в контуре синтеза.
Что касается технологического оборудования, то произошел переход от поршневых компрессоров к центробежным компрессорам. Внутренний теплообменник был реализован в конвертере синтеза для увеличения конверсии H 2 и N 2 до NH 3 . Конструкторы использовали рекуперацию водорода из продувочного газа (в таких установках, как системы КЦА) для повышения производительности или снижения энергопотребления предприятия. Конструкторы также внедрили системы сероочистки горячих исходных газов.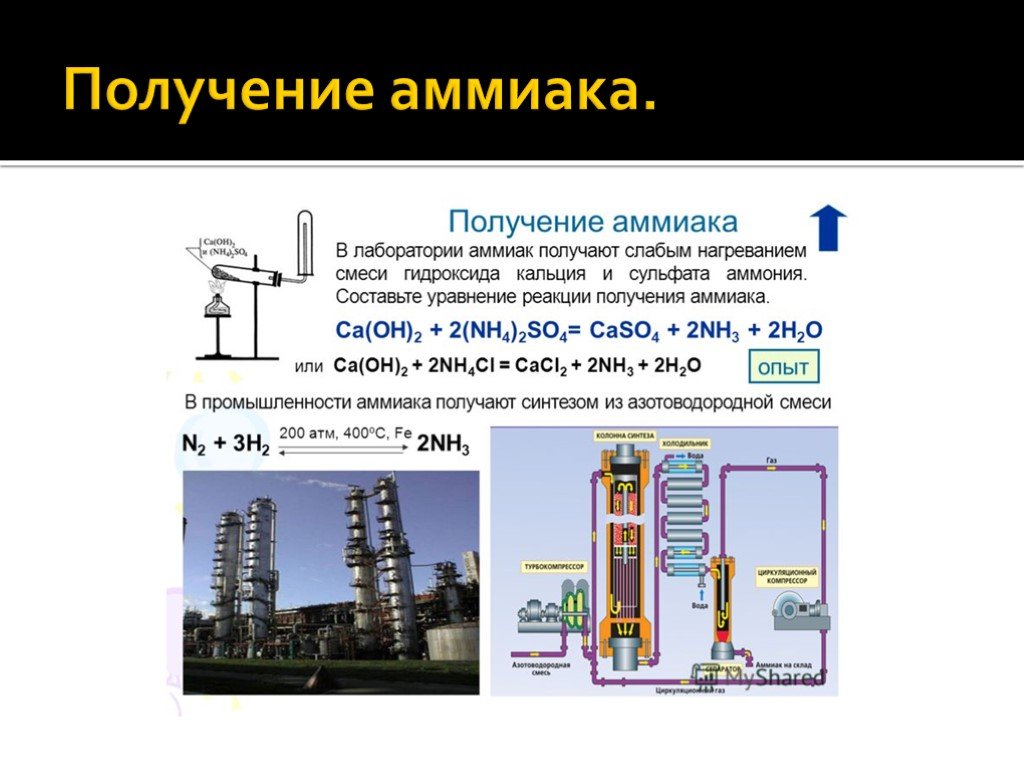 Были значительно улучшены катализаторы, используемые в риформинге, конверсии конверсии, метанировании и синтезе аммиака.
Были значительно улучшены катализаторы, используемые в риформинге, конверсии конверсии, метанировании и синтезе аммиака.
Для улучшения управления технологическим процессом и обеспечения безопасности распределенные системы управления (РСУ) для усовершенствованного управления технологическим процессом, а также системы безопасности (ПСБ) теперь являются стандартом на аммиачных заводах. Прежде чем какой-либо процесс будет запущен в работу, выполняются исследования опасностей и работоспособности (HAZOP) и анализ уровня защиты (LOPA). Достижения в области тренажеров и методов обучения гарантируют, что операторы и инженеры смогут безопасно и эффективно выполнять свои обязанности.
Это лишь некоторые из тысяч усовершенствований технологии и безопасности, которые были реализованы, чтобы сделать аммиачную промышленность одной из самых продуктивных и безопасных отраслей в мире.
Процитированная литература
- Геологическая служба США, «Азот (фиксированный) — статистика аммиака», Minerals.
 usgs.gov/minerals/pubs/historical-statistics/ds140-nitro.xlsx (последнее изменение: 28 января 2015 г.). 2016).
usgs.gov/minerals/pubs/historical-statistics/ds140-nitro.xlsx (последнее изменение: 28 января 2015 г.). 2016). - Слэк, А. В. и Г. Р. Джеймс (ред.), «Аммиак», части I, II и III, Марсель Деккер, Нью-Йорк, штат Нью-Йорк (1974).
- Смил В., «Обогащение Земли – Фриц Хабер, Карл Бош и трансформация мирового производства продуктов питания», MIT Press, Кембридж, Массачусетс (декабрь 2000 г.).
- Уильямс Г. и В. Паттабатула, «Сто лет производства аммиака — обзор значительного вклада в обеспечение населения продовольствием», 58-й ежегодный симпозиум по безопасности на аммиачных заводах и связанных с ними объектах, AIChE (25 августа — 29, 2013).
Благодарности
Авторы признательны компаниям KBR, ThyssenKrupp Industrial Solutions, Haldor Topsøe, Linde и Casale за предоставление технической литературы по соответствующим технологическим процессам.
Производство аммиака | CF Industries
Обзор
По своей сути CF Industries является производителем аммиака. Аммиак чаще всего используется в качестве удобрения или перерабатывается в другие азотные удобрения, такие как гранулированная мочевина и раствор карбамидо-аммиачной селитры.
Аммиак чаще всего используется в качестве удобрения или перерабатывается в другие азотные удобрения, такие как гранулированная мочевина и раствор карбамидо-аммиачной селитры.
Как и другие производители аммиака, мы используем процесс Габера-Боша, считающийся одним из самых впечатляющих нововведений 20-го века, который синтезирует азот из воздуха с водородом. В дополнение к усовершенствованию семеноводства и совершенствованию методов ведения сельского хозяйства благодаря «зеленой революции» рост использования азотных и других удобрений резко увеличил производство продуктов питания во второй половине XIX в.00с. Ежегодный показатель смертности людей от голода во всем мире за десятилетие снизился почти на 99% с 1960-х по 2010-е годы.
Таким образом, наша команда и продукты, которые мы производим, играют непосредственную и огромную роль в обеспечении населения мира достаточным количеством еды. Наше удобрение также ограничивает уничтожение лесов, которые играют роль в компенсации выбросов парниковых газов за счет секвестрации или естественного улавливания углекислого газа (CO2). Аммиак и продукты его переработки также используются для контроля выбросов и других промышленных процессов.
Аммиак и продукты его переработки также используются для контроля выбросов и других промышленных процессов.
Комплекс по производству аммиака в Дональдсонвилле 6
Завод по производству аммиака 6 в комплексе в Дональдсонвилле является крупнейшим заводом по производству аммиака в мире. Завод был введен в эксплуатацию в 2016 году.
Процесс Габера-Боша
Процесс Габера-Боша, также называемый аммиачным процессом Габера, или процесс синтетического аммиака, метод прямого синтеза аммиака из водорода и азота, разработанный немецким физико-химиком Фрицем Габером. Он получил Нобелевскую премию по химии в 1918 году за этот метод, который сделал производство аммиака экономически целесообразным. Метод был преобразован в крупномасштабный процесс с использованием катализатора и методов высокого давления Карлом Бошем, химиком-промышленником, получившим Нобелевскую премию в 1919 г.31 совместно с Фридрихом Бергиусом для исследований высокого давления.
Haber-Bosch был первым промышленным химическим процессом, в котором использовалось высокое давление для химической реакции.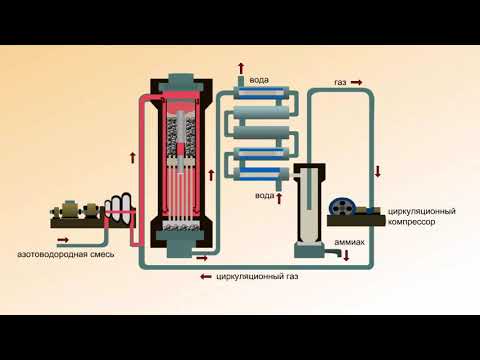
 usgs.gov/minerals/pubs/historical-statistics/ds140-nitro.xlsx (последнее изменение: 28 января 2015 г.). 2016).
usgs.gov/minerals/pubs/historical-statistics/ds140-nitro.xlsx (последнее изменение: 28 января 2015 г.). 2016).